4 Результаты и обсуждение
4.1 Характеристика фауны мелких млекопитающих степных сообществ Северного Казахстана
4.1.1 Список мелких млекопитающих степей Северного Казахстана.
Исследования биоразнообразия территории Северного Казахстана, в том числе и Павлодарской области начинается еще со второй половины XVIII в. Из письменных источников того времени известен труд группы ученных Российской Академии наук «Путешествие по разным местам Российского государства», где впервые приводятся данные о гидрографии, рельефе, почвах, флоре, в том числе и фауне [109, с. 48]. Затем следуют работы В. Н. Белова «Обзор грызунов Северного Казахстана» (1934) [156]; Б. А. Кузнецова «Млекопитающие Казахстана» (1948) [157]; А. В. Афанасьева и др. «Звери Казахстана» (1953) [158]; В. Н. Шнитникова «Животный мир Казахстана» ч. II, Северный Казахстан [159]; «Млекопитающие Казахстана» под редакцией А. А. Слудского и др., в четырех томах [160–162].
Наиболее обстоятельный современный фаунистический анализ населения мелких млекопитающих региона отражен в трудах А. О. Соломатина (2007), которым определен видовой состав и численность позвоночных животных Павлодарского Прииртышья [116, с. 175–178], а также К. У. Базарбекова, О. В. Ляхова (2004) [163], Н. Т. Ержанова и др. (2016) [109, с. 196–215], Ю.Н. Литвинова и др. (2015) [164].
Одной из задач нашей работы было проведение инвентаризации фауны мелких млекопитающих и дополнение списка видов региона. При составлении списка были использованы литературные источники фаунистического, экологического и териологического содержания и материалы автора [165, 166]. В настоящий список включены все систематические формы, когда-либо зарегистрированные на территории Северного Казахстана (таблица 2).
Согласно нашим исследованиям и сведениям, содержащимся в литературных источниках, группа мелких млекопитающих (Insectivora и Rodentia) насчитывает в пределах рассматриваемой территории 32 вида. Наиболее разнообразно представлен отряд Грызунов – 25 видов (78 %), которые относятся к трем семействам и 16 родам. Отряд Насекомоядных представлен семью видами (22 %), включающий одно семейство и три рода.
Таблица 2 – Список мелких млекопитающих Северного Казахстана
|
Виды |
Численность |
|
1 |
2 |
|
Отряд Насекомоядные (Insectivora) |
|
|
1 Семейство землеройковые – Soricidae Fischer, 1814 |
|
|
Малая белозубка (Crocidura suaveolens Pall., 1811) |
Р |
|
Кутора обыкновенная (Neomys fodiens Pennant, 1771)* |
О |
|
Обыкновенная бурозубка (Sorex araneus L., 1758) |
? |
|
Тундряная бурозубка (S. tundrensis Merriam, 1900) |
? |
|
Средняя бурозубка (S. caecutiens Laxmann, 1785)* |
? |
|
Крошечная бурозубка (S. minutissimus Zimmermann, 1780) |
Р |
|
Малая бурозубка (S. minutus L., 1766) |
? |
|
Отряд Грызуны (Rodentia) |
|
|
1 Семейство тушканчиковые – Dipodidae Fischer, 1817 |
|
|
Тушканчик большой (Allactaga major, Kerr, 1792)* |
Р |
|
Тушканчик прыгун (A. sibirica Forster, 1778)* |
Р |
|
Тушканчик мохноногий (Dipus sagitta Pall., 1773)* |
Р |
|
Лесная мышовка (Sicista betulina Pall., 1779)* |
? |
|
Степная мышовка (S. subtilis Pall., 1773) |
О |
|
2 Семейство хомяковые – Cricetidae Fischer, 1817 |
|
|
Джунгарский хомячок (Phodopus sungorus Pall., 1773) |
О |
|
Хомяк обыкновенный (Cricetus cricetus L., 1758)* |
О |
|
Хомячок Эверсмана (Allocricetulus eversmanni Brandt, 1859* |
О |
|
Хомячок барабинский (Cricetulus barabensis Pall., 1773)* |
О |
|
Хомячок серый (C. migratorius Pall., 1773)* |
Р |
|
Красная полевка (Myodes rutilus Pall., 1779) |
М |
|
Полевка плоскочерепная (Alticola strelzovi Kastschenko, 1901)* |
Р |
|
Обыкновенная слепушонка (Ellobius talpinus Pall., 1770) |
Р |
|
Степная пеструшка (Lagurus lagurus Pall., 1773) |
М |
|
Водяная полевка (Arvicola amphibius L., 1758)* |
О |
|
Узкочерепная полевка (Microtus gregalis Pall., 1779) |
О |
|
Полевка-экономка (M. oeconоmus Pall., 1776) |
О |
|
Полевка общественная (M. socialis Pall., 1773)* |
? |
|
Обыкновенная полевка (M. arvalis Pall., 1779 ) |
Р |
|
Восточноевропейская полевка (M. levis Miller, 1908) |
Р |
|
3 Семейство мышиные – Muridae Gray, 1821 |
|
|
Мышь-малютка (Micromys minutus Pall., 1771) |
O |
|
Малая лесная мышь (Apodemus uralensis Pall., 1811) |
М |
|
Полевая мышь (A. agrarius Pall., 1771)* |
М |
|
Виды |
Численность |
|
1 |
2 |
|
Отряд Грызуны (Rodentia) |
|
|
3 Семейство мышиные – Muridae Gray, 1821 |
|
|
Мышь домовая (Mus musculus L., 1758)* |
М |
|
Крыса серая (Rattus norvegicus Berkenhout, 1769)* |
М |
|
*виды, не отмеченные автором Примечания: 1 ? – нет данных; 2 М – многочисленен; 3 О – обычен; 4 Р – редок |
|
Кроме того, в зоне техногенной нагрузки Павлодарской области нами впервые обнаружен новый вид для региона – восточноевропейская полевка (Microtus levis Miller, 1908 (= M. rossiaemeridionalis Ognev, 1924)). Определение вида осуществлялось сотрудником лаборатории экологии сообществ позвоночных животных ИСиЭЖ СО РАН к.б.н. Т.А. Дупал. Подтверждение вида проведено сотрудниками «Федерального научного центра Биоразнообразия наземной биоты Восточной Азии» ДВО РАН И. В. Картавцевой и И. Н. Шереметьевой (устное сообщение) [167].
4.1.2 Фаунистические комплексы мелких млекопитающих степей Северного Казахстана и севера Кулундинской равнины.
По териогеографическому районированию Северный Казахстан входит в Центрально-Азиатскую подобласть. Павлодарская область относится к Казахстано-Монгольской провинции, Казахстанскому округу, Восточному степному участку [168].
В основу зоогеографических построений положено представление о географическом фаунистическом комплексе, под которым понимается исторически сложившаяся общность видовых групп (родов и подродов), имеющих одинаковый или близкий характер распространения в силу одинаковой приспосабливаемости к особенностям природной среды. Рассматривая фаунистические комплексы, необходимо обозначить основные принципы их выделения. Классическое определение фаунистических комплексов, как основы зоогеографического анализа любой территории получило широкое развитие в работах ученых. Каждый фаунистический комплекс образован совокупностью видов, принадлежащих к разным биогеографическим группам, согласно общности их исторического формирования и современных ареалов. Обращение к фауногенетическим корням видов вызвано объективной необходимостью, поскольку зоогеографический анализ без привлечения фауногенетических сведений не даёт сколько-нибудь объективного мнения [169–173]. При рассмотрении современного распространения животного населения наиболее плодотворный результат дает синтез историко-фаунистического, экологического и ландшафтного подходов к изучению фауны региона [174]. Для реализации экологического подхода используют экологическую типизацию мелких млекопитающих: передвижение, отношение к влажности, зональную приуроченность, предпочитаемость биотопов и т.д. На практике, оценивая экологическую специфику, зоологи широко используют понятия: «таежные», «лесные», «горные» виды и т.п. Они, помимо фаунистического, генетического и ценотического, приобретают и экологический смысл [175].
Наиболее комплексной характеристикой мелких млекопитающих степей Северного Казахстана, будет являться описание эколого-фаунистических комплексов мелких млекопитающих, населяющих различные по составу и структуре растительности участки степей. Видовые составы фаунистических комплексов степей Северного Казахстана приведены по В. В. Кучеруку (1959), Ю. А. Мекаеву (1987) и Е. А. Шварцу (1989) [170, с. 11–16; 172, с. 118–130; 176]. Смешение разнородных фаунистических элементов в пределах геоморфологических структур региона определяет сложный состав и структуру фауны мелких млекопитающих на их территории (рисунок 5).
В пределах степей Северного Казахстана зарегистрировано 16 видов мелких млекопитающих. Из них к отряду Насекомоядных относятся 5 видов, отряду Грызунов – 11 видов. Проведенный анализ показал, что наиболее разнообразной оказалась группа Бореального географического комплекса – 6 видов (37,5 %). Вторыми по численности следуют представители Казахстано-Европейского комплекса – 4 вида (25 %). Виды Европейского и Евро-Маньчжурского фаунистических комплексов составляют по 19 и 12,5 %, на их долю приходится по три и два вида, соответственно. Монгольский фаунистический комплекс представлен одним видом – джунгарским хомячком и составляет 6 % от общего числа.
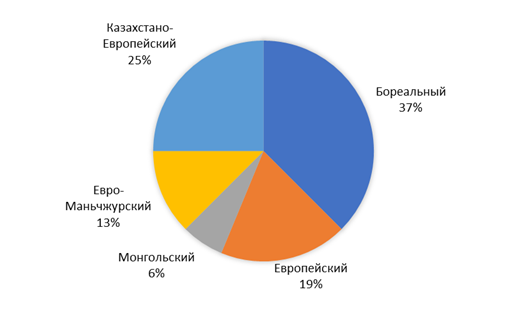
В пределах севера Кулундинской равнины зарегистрировано 13 видов мелких млекопитающих. Из них к отряду насекомоядных относятся 4 вида, отряду грызунов – 9 видов. Проведенный анализ показал, что состав и долевое участие представителей мелких млекопитающих схож со степями Северного Казахстана и также представлен пятью фаунистическими комплексами (рисунок 6). Наиболее разнообразной также, как и в пределах Павлодарской области, оказалась группа Бореального географического комплекса – 5 видов (39 %). В отличие от степей Северного Казахстана второе место занимают представители Европейского фаунистического комплекса (23 %). Виды Казахстано-Европейского и Евро-Маньчжурского фаунистических комплексов составляют по 15 %, а на их долю приходится по 2 вида. Монгольский фаунистический комплекс также представлен одним видом – джунгарским хомячком, что составляет 8 % от общего числа.
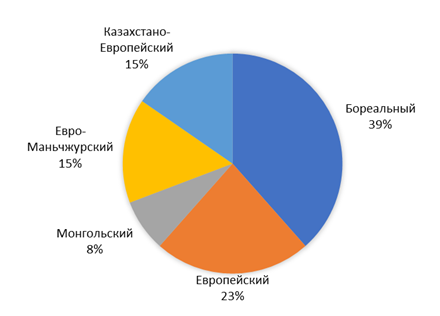
Экологической предпосылкой в формировании гетерогенной фауны мелких млекопитающих, имеющей связи практически со всеми сопутствующими фаунистическими комплексами, послужили различные природные условия в представленных географических ландшафтных зонах (таблица 3) [177].
Таблица 3 – Принадлежность видов мелких млекопитающих степей Северного Казахстана и севера Кулундинской равнины к фаунистическим комплексам Евразии
|
Фаунистические комплексы |
||||
|
Бореальный |
Европейский |
Монгольский |
Евро-Маньчжурский |
Казахстано-Европейский |
|
Sorex minutus S. caecutiens S. araneus S. tundrensis S. minutissimus Myodes rutilis Microtus oeconоmus
|
Apodemus uralensis Microtus arvalis Arvicola amphibius M. levis |
Phodopus sungorus |
Crocidura suaveolens Apodemus agrarius |
Sicista subtilis Ellobius talpinus Lagurus lagurus Microtus gregalis
|
Степная зона характеризуется в первую очередь, весьма специфическими и крайне однообразными условиями существования на громадных пространствах. Специфичность и однообразие этих условий столь велики, что для ряда систематических групп или отдельных видов млекопитающих степная зона является незаселенным участком внутри ареала [178]. В то же время, на приграничной лесостепной территории мелкие млекопитающие характеризуются более высоким обилием и видовым разнообразием, из которых в степную зону проникают лишь немногие из числа распространенных: обыкновенная и красная полевки, полевка-экономка, малая лесная мышь, мышь-малютка. В то же время из пустынной зоны сюда проникают обыкновенная слепушонка и малая белозубка.
По мнению В. В. Кучерука (2006), степная зона характеризуется крайней бедностью видового состава насекомоядных млекопитающих, и в их числе нет ни одного степного вида [178, с. 409]. Из семейства землеройковых в пределы степной зоны заходит ограниченное число широко распространенных видов. Но ни один из этих видов не заселяет всей или большей части степной зоны. В своем распределении землеройки приурочены здесь в основном к азональным биотопам (долинам рек и берегам озер). Эти зверьки относятся, по терминологии А. Н. Формозова (1946), к типичным хионофилам – снеголюбам [179]. Обладая сравнительно высокой теплоотдачей и крайне напряженным энергетическим обменом, землеройки могут переживать морозы только под защитой достаточно высокого снежного покрова. В степях с их непостоянным, плотным и метаморфизированным снежным покровом, продолжительной морозной зимой, землеройки благополучно перезимовывают лишь в снежных наносах. Однако, глубокое промерзание почвы и вечная мерзлота при наличии достаточно высокого снежного покрова не ограничивают численность землероек, что подтверждается обилием их в лесотундре и кустарниковой тундре [178, с. 409].
Отряд Грызунов, как по числу видов, так и по числу особей является самым многочисленным отрядом Палеарктики. В его составе есть группы, характерные только для степной зоны, это степная мышовка, джунгарский хомячок и степная пеструшка. Отсутствуют степные эндемики среди мышей. Далеко проникают в степь из смежных природных зон полевая мышь, лесная мышь и мышь-малютка, имеющие весьма широкие ареалы [178, с. 406–414].
Несмотря на то, что Казахстано-Европейский фаунистический комплекс по числу видов уступает Бореальному, численность этих видов значительно выше, поэтому фауну мелких млекопитающих степей Северного Казахстана можно отнести к степному типу. При этом большая часть входящих в него видов, являются эндемиками (степная мышовка, джунгарский хомячок, степная пеструшка). Территория севера Кулундинской равнины располагается в подзоне южной лесостепи, поэтому здешнее население мелких млекопитающих в наибольшей степени представлено представителями Бореального и Европейского географических фаунистических комплексов – пять (39 %) и четыре (23 %) вида, соответственно. В первый из них, входят обыкновенная, тундряная, малая и средняя бурозубки и полевка-экономка, причем их численность относительно выше, чем у представителей других фаунистических комплексов. Европейский фаунистический комплекс представлен такими немногочисленными видами, как малая лесная мышь, водяная, обыкновенная и восточноевропейская полевки. В отличии от степей Северного Казахстана, Казахстано-Европейский фаунистический комплекс уступает здесь Европейскому.
4.1.3 Видовой обзор мелких млекопитающих и их распределение по биотопам и зонам техногенной нагрузки.
Белозубка малая (Crocidura suaveolens Pall., 1811). Длина тела не превышает 58 мм, хвост составляет около 50 % длины тела. У нее небольшая голова с вытянутой в длинный хоботок мордочкой. Ушные раковины в отличие от других бурозубок хорошо развиты и крупные. Зубы без коричневого пигмента [180, с. 87–88]. Окраска спины и боков от пепельно-серой до коричневато-сероватой, брюхо серо-беловатое, переход выражен не резко. Хвост двухцветный, но граница окраски заметна плохо. Он покрыт ровным мехом, из которого выступают отдельные волоски [116, с. 73].
По своему происхождению малая белозубка относится к Евро-Маньчжурскому фаунистическому комплексу. Ареал вида простирается от Атлантического до Тихого океана и включает в себя степную, лесостепную и полупустынную зоны Евразии, северо-запад Африки и некоторые крупные острова Средиземного моря [180, с. 88; 182]. Обитает в азональных и интрозональных местообитаниях – в закустаренных или луговых поймах. Часто встречается в антропогенно нарушенных местообитаниях, на залежах, пашнях, на развалинах жилья. Тяготеет к синантропии, встречается в разнообразных жилых и технических постройках [181, с. 323; 183]. В окрестностях г. Павлодар обычна. Населяет поля, сады, огороды, часто встречается в домах сельского типа [116, с. 73].
Малая белозубка преимущественно ведет оседлый образ жизни. Питается исключительно животной пищей, основу которой составляют насекомые на всех стадиях развития. Суточная норма потребления пищи в 1,5–3 раза превышает собственную массу землеройки [160, с. 114]. В лесу малая белозубка укрывается под валежником [180, с. 89]. Гнездо устраивает в траве, в углублениях почвы и в норах грызунов [116, с. 73]. Однако в сухих степях и полупустынях Средней Азии, видимо, роет норы [180, с. 89]. Размножается всю теплую часть года, период размножения может длиться до 7–8 месяцев. В помете бывает до 10 детенышей [116, с. 73; 181, с. 324].
В зонах техногенной нагрузки малую белозубку отлавливали в разнотравно-полынной степи с элементами древесной растительности (И1, И2) и разнотравно-ковыльно-полынной степи (И3) с одинаково не высоким показателем численности (0,1 особи на 100 к/с), а также в типчаково-полынной степи с элементами древесной растительности (Б6, Ф9) – 0,2 особи на 100 к/с. Суммарное обилие малой белозубки составило 0,08 особи на 100 к/с.
В популяции малой белозубки в окрестностях г. Павлодар выявлено равное соотношение самцов и самок. За период исследований были встречены только неполовозрелые сеголетки (n=8).
Обыкновенная бурозубка (Sorex araneus L., 1758). Это довольно крупная бурозубка: длина тела 60-80 мм, вес 9–15 г. Малопушистый хвост составляет чуть больше половины длины тела [180, с. 59]. Окраска тела обычно трехцветная, с заметной чепрачностью, спина от темно-коричневой до черной, бока палевые, брюшко серовато-белое [135, с. 38].
Обыкновенная бурозубка своим происхождением связана с Бореальным фаунистическим комплексом [170, с. 11]. Ареал бурозубки охватывает почти всю Европу, Западную Сибирь и юг Восточной Сибири [180, с. 59]. Обитатель различных ландшафтов. В лесу поселяется в местах с обильным буреломом и толстой и рыхлой лесной подстилкой, любит поймы лесных рек и лесные овраги. В лесостепи предпочитает населять березовые колки, в степи и пустыне – тростниковые заросли у озер. Избегает сильно заболоченных мест и редких сухих сосновых насаждений. В Павлодарской области распространена повсеместно [116, с. 70].
Живет оседло. Пользуется временными убежищами, которые устраивает в различных пустотах. Постоянные жилища с гнездом устраивает только на время размножения [116, с. 70]. Обладает полифазной суточной активностью, с пиком в ночное время. Питается преимущественно животной пищей, употребляя более широкий спектр кормов по сравнению с другими видами бурозубок, включая насекомых, лягушек, ящериц, мелких млекопитающих, а также растительные корма [181, с. 215]. Размножается с мая по август, принося два приплода по 6–8 детенышей. Самки первого выводка участвуют в размножении [116, с. 70].
В зонах техногенной нагрузки обыкновенную бурозубку единично отлавливали в разнотравно-типчаковой (И5) и полынно-ковыльной степях (Б7) с одинаково низким показателем численности – 0,1 особи на 100 к/с. Суммарное обилие обыкновенной бурозубки составило 0,02 особи на 100 к/с.
Тундряная бурозубка (Sorex tundrensis Merriam, 1900). Размеры средние, телосложение массивное. Голова с укороченной широкой лицевой частью, и умерено вздутой и широкой в лобной области мозговой коробкой. Сужение в области глаз почти не выражено. Длина тела 48–72 мм. Хвост короткий, у большинства животных не превышающий 50 % от длины тела, покрытый у молодых животных короткими немного распушенными волосами, образующими концевую кисточку [181]. Окраска с четко выраженной чепрачностью: спина от бурой до черной, бока и брюшко серебристо-белые [135, с. 63].
Тундряная бурозубка своим происхождением связана с Бореальным фаунистическим комплексом [170, с. 11]. Эта бурозубка наиболее многочисленна в таежных лесах и тундре Азии, южная граница ареала проходит по горам Алтая, Забайкалья и Приамурья. Небольшой участок находится на северо-западе Северной Америки – на Аляске и Юконе. Этот зверек малотребователен к условиям обитания. На обширной территории ареала тундряная бурозубка населяет самые разнообразные природные комплексы: равнинную и горную тайгу, боры и широколиственные леса, лесные колки и приречные кустарниковые поймы в лесостепи и тундре, в горах поднимается до гольцового пояса [180, с. 63–64]. По данным А. О. Соломатина (2007) в Павлодарской области отлавливалась только в горах Баянаул [116, с. 70].
Рацион питания бурозубки изменчив в зависимости от конкретных условий обитания. Так, в приморских лесах она ест преимущественно жуков, в лесостепи – саранчовых, а в тундре преобладающих там дождевых червей, а также грибы. На юге ареала тундряная бурозубка за теплое время приносит два помета, а на севере, где лето короткое, размножается только один раз в год. Это компенсируется большим размером приплода – до 11 детенышей на севере и только 4-7 на юге [180, с. 64].
В зонах техногенной нагрузки тундряная бурозубка отмечена в разнотравно-полынной степи с элементами древесной растительности (И2) и полынной степи (Ф12) с одинаково низким показателем численности 0,1 особи на 100 к/с. Более высокая численность отмечена в типчаково-полынной степи с элементами древесной растительности (Б6, Ф9) и полынно-ковыльной степи (Б7) – 0,4 особи на 100 к/с. Суммарное обилие бурозубки составило 0,15 особи на 100 к/с.
В популяции тундряной бурозубки в окрестностях г. Павлодар выявлено преобладание самцов над самками (64 % и 36 %). Среди отловленных животных преобладали сеголетки неполовозрелые (82 %), из них 63 % приходится на самцов.
Крошечная бурозубка (Sorex minutissimus Zimmermann, 1780). Самая мелкая из наших землероек (вес тела до 4 г, длина тела 30-50 мм). Отличается от других видов формой головы, она у нее уплощенная, со слабо вытянутым и притупленным рострумом. Волосы на довольно коротком (половина длины тела) хвосте обычно распушены [180, с. 77]. Окраска спины от серо-коричневой до темно-бурой и почти черной, брюшко серебристо-серое; местами бывает выражена чепрачность [135, с. 39].
Крошечная бурозубка по своему происхождению относится к Бореальному фаунистическому комплексу [170, с. 11]. Ареал очень широк: вся таежная зона Евразии от Скандинавии до тихоокеанского побережья. Есть этот вид и на прилегающих островах – Сахалине, некоторых Курильских и Японских. Совсем недавно найдена на Аляске [180, с. 77–78]. Обитает преимущественно в лесу и в лесостепи. Населяет различного типа леса, болота, поймы рек. Везде крайне редка. В Северном Казахстане была встречена лишь дважды [116, с. 71–72].
Копает этот зверек очень неохотно, а большую часть времени проводит в лесной подстилке. Питается насекомыми и их личинками. У крошечной бурозубки крайне интенсивный обмен веществ. В сутки съедает корма в четыре раза больше собственного веса. Размножение, как и у других видов бурозубок, длится все теплое время года. Самки приносят за сезон, как правило, два приплода по четыре-семь детенышей в каждом [180, с. 79–80].
В зонах техногенной нагрузки крошечная бурозубка единично встречена в типчаково-полынной степи с элементами древесной растительности на фоновом пробном участке (Ф9).
Малая бурозубка (Sorex minutus L., 1766). Длина тела 40–64 мм, вес от 3 до 5 г. Мордочка довольно длинная и узкая, хвост также длинный (около 2/3 длины тела) и пушистый. Мех мягкий, бархатистый, особенно зимой; буровато-серый с рыжевато-кофейным оттенком на спине, на боках он постепенно светлеет и плавно переходит в сероватый с палевым оттенком на брюшке [180].
Малая бурозубка по своему происхождению относится к Бореальному фаунистическому комплексу [170, с. 11]. Ареал вида охватывает лесные и лесостепные области Европы, Сибири (на востоке простирается до Прибайкалья), Северного Казахстана; изолированный участок имеется в горах Тянь-Шаня [180, с. 71]. Предпочитает селиться по сырым, но светлым и не заболоченным местам, в смешанных лесах, чаще встречается в захламленных местах, заросших травой. Избегает сильно задернованной почвы и открытых сухих мест. В Павлодарской области встречается преимущественно в пойме Иртыша [116, с. 71].
Малая бурозубка охотится на поверхности почвы и в лесной подстилке. Суточный рацион составляет 250 % от ее веса и состоит из мелких жуков, гусениц, мух и личинок. Строит выводковые гнезда в виде шаровидных сооружений из травы, мха, листьев с боковым входом – расположенных в естественных пустотах на земле, лежащих в колодах и трухлявых пнях. В год бывает два помета, в каждом из которых от четырех до десяти детенышей [180 с. 72].
В зонах техногенной нагрузки малая бурозубка единично отмечена в разнотравно-полынной степи с элементами древесной растительности (И2), в полынной степи (Ф12), а также в типчаково-полынной степи с элементами древесной растительности (Ф9). Суммарное обилие малой бурозубки составило 0,03 особи на 100 к/с.
За период исследований были встречены только неполовозрелые сеголетки (n=3), из которых два самца и одна самка.
Степная мышовка (Sicista subtilis Pall., 1773). Размеры мелкие, длина тела до 77 мм, хвоста – до 86 мм, причем последний не более чем на 1/3 превышает длину тела. Ступня относительно короткая (до 15,8 мм); ее задний подошвенный бугорок сравнительно слабо вытянут в продольном направлении. Ушные раковины темно-бурые или почти черные, со светлой каймой по краю. Общая окраска спины серая или буровато-серая с желтовато-охристым налетом. Вдоль середины спины проходит черная полоска, к которой с боков примыкают светлые полосы с размытыми наружными краями, а кнаружи от них обычно имеются продольно вытянутые темные участки, наиболее ясно выраженные в задней части спины [134, с. 191].
Вид, который своим происхождением связан с Казахстано-Европейским фаунистическим комплексом, а по характеру ареала тяготеет к западной половине степной зоны [182, с. 69]. Степная мышовка распространена в зоне лесостепей, степей и полупустынь Евразии, от Венгрии и Румынии на западе – до Байкала на востоке. В восточной части ареала из-за прерывистого расположения степных участков встречается спорадично. В Казахстане распространена в северной части, преимущественно в открытых степных ландшафтах [134, с. 192; 161, с. 155]. В Павлодарском Прииртышье встречается повсеместно [116, с. 121].
В степной зоне степная мышовка обычна, а местами многочисленна. Предпочитает заселять открытые пространства, заросшие ковылем и типчаком, встречается на солонцах, поросших типчаком, в пырейных лугах близ водоемов, а также в различных кустарниковых зарослях. Ведет оседлый образ жизни, перемещений, носящих массовый характер, не отмечено. За исключением сезона размножения, ведет одиночный образ жизни, не образуя групповых скоплений. Активна мышовка в сумеречные и ночные часы. При наступлении похолодания, зверьки становятся менее активными и в сентябре залегают в спячку, а просыпаются в начале апреля [180, с. 296]. Убежищ для себя не готовит, а занимает пустующие норки грызунов и трещины в почве. По характеру питания мышовка относится к насекомоядно-зерноядным животным, причем насекомые составляют большую часть поедаемых кормов. Предпочтение отдают насекомым с хорошо развитым жировым телом – бабочкам, особенно ночным, гусеницам, саранчовым, клопам и паукам. Из растительных кормов мышовки поедают семена, цветы, луковицы. Питаясь концентрированными и сочными кормами, мышовки утоляют жажду и запасают большое количество жира, необходимого им для зимней спячки [116, с. 121; 161, с. 157–158].
В зонах техногенной нагрузки степную мышовку отлавливали в разнотравно-ковыльно-полынной (И3, И4) и полынно-ковыльной степях (Б7) с показателем численности 1,4 и 1,3 особи на 100 к/с соответственно. Более редко она встречалась в разнотравно-типчаковой (И5) и полынной степях (Ф11, Ф12), а также в типчаково-полынной степи с элементами древесной растительности (Б6, Ф10) (0,6; 0,3 и 0,2 особи на 100 к/с соответственно). Суммарное обилие степной мышовки составило 0,54 особи на 100 к/с.
В популяции степной мышовки в окрестностях г. Павлодар выявлено преобладание самцов над самками (65,4 % и 34,6%). Среди разных возрастных групп их соотношение различное. Так среди перезимовавших и половозрелых сеголеток доля самцов составляет 58,3 % и 93 % соответственно, а в сообществе неполовозрелых сеголеток – 54 %.
Весной в популяции преобладают взрослые перезимовавшие животные (75 %, n=9), из них 78 % приходится на самцов (рисунок 7). Сеголетки в этот период составляют незначительную часть населения (25 %, n=3). В начале лета увеличивается доля прибылых зверьков, суммарная доля которых составляет 84,2 % (n=16), причем количество неполовозрелых сеголетков в три раза выше, чем половозрелых. К середине лета соотношение долей неполовозрелых и половозрелых сеголетков выравнивается. Доля взрослых перезимовавших животных в начале лета заметно сокращается (15,8 %, n=3), а к концу лета и осенью перезимовавшие мышовки не встречались. Основу населения степной мышовки в конце лета и осенью составляют неполовозрелые сеголетки (100 %), среди которых доминируют самцы (57,1 %).
В природе, по данным автора Van den Brink (1957) эти мышовки доживают до трехлетнего возраста [184].
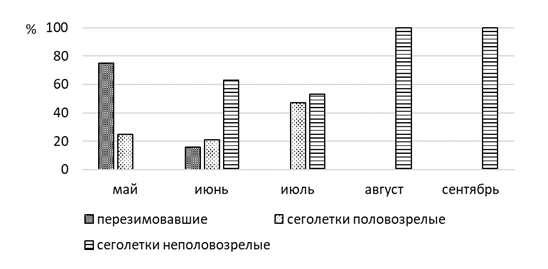
Размножается вид в конце мая – начале июня [134, с. 192; 161,
с. 160–161]. У степных мышовок ежегодно бывает один помет, число детёнышей в помете от 2 до 7, чаще 4–6.
По нашим данным беременные самки были встречены с середины мая до начала июля.
Средняя плодовитость в зоне техногенной нагрузки составила – 4,3 (n=5), а максимальное количество эмбрионов – 6. Стоит отметить, что в импактной зоне электролизного завода (И4) была обнаружена самка с тремя погибшими эмбрионами.
Джунгарский хомячок (Phodopus sungorus Pall., 1773). Мелкий по размерам хомячок с коротким хвостом, едва выступающим из меха. Длина тела до 102 мм, хвоста – до 18 мм. Подошвы задних лап густо покрыты мехом, часть мозолей на них редуцированы. В окраске верха преобладают буровато- или охристо-серые тона, которые тремя «мысами» вдаются в светлую окраску боков. По хребту проходит резко-очерченная черная полоса [134, с. 309; 161, с. 457].
Джунгарский хомячок относится к Монгольскому фаунистическому комплексу [178, с. 421; 182, с. 69]. Населяет степные и частично лесостепные и полупустынные ландшафты от Северо-Восточного Забайкалья, Минусинской степи и Западной Сибири до Казахского нагорья, Тарбагатая, Гобийского и Монгольского Алтая и Юго-Восточной Монголии. В Казахстане в полупустынные районы он почти не проникает. На севере его распространение ограничивается лесными массивами, а на юге сухими опустыненными пространствами. Этот зверек распространен в северных, северо-восточных и центральных частях Казахстана [161, с. 460]. В последние десятилетия он интенсивно продвигается на запад. В Павлодарской области распространен повсеместно. Его численность резко колеблется по годам. Заселяет различные степные угодья, как с обильным, так и с бедным растительным покровом. Встречаются на посевах хлебов и многолетних трав, залежах, в полезащитных лесополосах и березовых колках. Однако наиболее часто встречается в местах, где заросли кустов чередуются с небольшими полянами, в полузакрытых местах [116, с. 139].
Это одиночный, оседло живущий, не впадающий в спячку зверек. Активен летом в ночное время, зимой – днем. Роющая способность невелика. Как и у других хомячков, норы его – это ветвящиеся ходы диаметром около 3 см с одной или двумя камерами, из которых зимняя может располагаться на глубине до 1 м. Охотно селится в норах других грызунов и нередко по соседству с ними, в трещинах почвы, под камнями и в других убежищах. Хомячок питается преимущественно семенами, реже насекомыми и вегетативными частями растений. Взрослые хомячки за сутки съедают 10–13 г корма. В защечных мешках у них отмечали обычно 4–5, иногда до 10,5 г различного корма. Вероятно, в естественных условиях они могут обеспечить суточную потребность в пище за один выход из норы с учетом, что при этом наполняют и желудок. К зиме накапливают значительное количество подкожного жира, помогающего зверьку сравнительно легко переносить отрицательные температуры [134, с. 310; 161, с. 462].
В зоне техногенной нагрузки джунгарского хомяка отлавливали в различных открытых биотопах с невысоким показателем численности. Больше всего его обилие отмечено в полынно-ковыльной степи (Б7) – 1,1 особи на 100 к/с, и значительно меньше в разнотравно-типчаковой (И5) и разнотравно-ковыльно-полынной степях (И3, И4) – 0,3 и 0,2 особи на 100 к/с соответственно. Еще меньше его обилие в разнотравно-полынной степи с элементами древесной растительности (И1, И2), а также в полынной (Ф12) и типчаково-полынной степи с элементами древесной растительности (Ф9) (по 0,1 особи на 100 к/с). Суммарное обилие джунгарского хомячка составило 0,2 особи на 100 к/с.
В популяции джунгарского хомячка в окрестностях г. Павлодар выявлено преобладание самцов над самками (64 % и 36%). Так среди разных возрастных групп их соотношение различное. Так у перезимовавших и половозрелых сеголеток доля самцов составляет
75 % и 60 % соответственно, а в сообществе неполовозрелых сеголеток – 63 %.
В мае и июне незначительно преобладают сеголетки (57 %, n=4), а перезимовавшие животные составляют 42,8 % (n=3). К середине лета соотношение долей неполовозрелых и половозрелых сеголетков выравнивается, доля взрослых перезимовавших животных заметно сокращается (14 %, n=1), а к концу лета и осенью перезимовавшие хомячки не встречались. Основу населения джунгарского хомячка в конце лета и осенью составляют неполовозрелые сеголетки (63 %), среди которых доминируют самцы (60 %) (рисунок 8).
В результате интенсивного размножения хомячков их возрастной состав постоянно обновляется. Судя по низкой численности этих зверьков, продолжительность их жизни не превышает нескольких месяцев [161, с. 465].
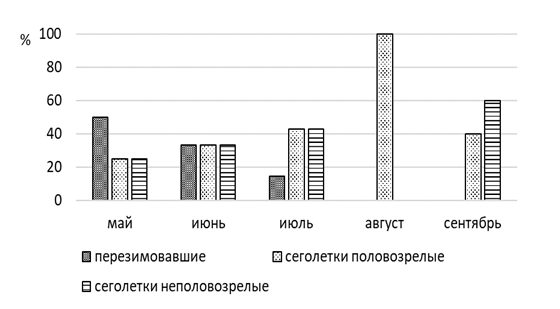
Джунгарский хомячок интенсивно размножается в течение всего теплого времени года, при этом беременных самок отлавливали и зимой. С апреля по сентябрь взрослые самки приносят по 5–6 выводков, прибылые могут размножаться, достигнув веса 20 г или даже немного меньше. В помете бывает от 4 до 11, чаще всего 6–7 детенышей. Резорбция эмбрионов редка. Численность сильно колеблется по годам, но никогда не бывает высокой [161, с. 463–464].
По нашим данным первая самка с плацентарными пятнами была отловлена в начале июня, а беременные самки встречались с июля до середины августа. Средняя плодовитость в зоне техногенной нагрузки составляла – 6,3 эмбрионов (n=6), а максимальное их количество составило 8 (n=2). В импактной зоне электролизного завода (И4) была встречена беременная самка с восемью эмбрионами, один из которых резорбцировался.
В окрестностях электролизного завода обнаружены джунгарские хомячки с патологиями. Так в импактной зоне (И4, И5) у троих животных обнаружена деформированная селезенка, в буферной зоне электролизного и алюминиевого заводов (Б6, Б7) обнаружены два зверька с опухолями на животе и одна самка с одной почкой и одной фаллопиевой трубой.
Обыкновенная слепушонка (Ellobius talpinus Pall., 1770). Зверек, приспособленный к подземному образу жизни. Длина тела 100–130 мм, длина хвоста до 17 мм. Туловище вытянутое, вальковатое. Характерны сильно выдающиеся вперед, длинные резцы, глаза очень маленькие, ушные раковины отсутствуют. Голова по отношению к туловищу крупнее, чем, например, у мыши, полевки и др. Рот небольшой, защищенный волосками от попадания земли. Губы подвернуты в рот. Окраска меха от светлой, желтовато-охристой до темной черно-бурой. Лоб и область около глаз черные, затылок черновато- или беловато-серый. Брюхо серое с палевым оттенком [134, с. 342–343].
Обыкновенная слепушонка относится к Казахстано-Европейскому фаунистическому комплексу [182, с. 69]. Населяет пустыни, полупустыни и степи от юга Украины, Крыма, Среднего Поволжья, Заволжья, Южного Приуралья, Зауралья, Казахстана, Средней Азии, Омской и Новосибирской областей, Алтайского края, Тувы, а также Северо-Западного Китая и значительной части Монголии [180, с 404]. В Казахстане слепушонка распространена повсеместно, за исключением таежной части Южного Алтая. Наибольшей численности достигает в сухостепных и полупустынных ландшафтах [162, с. 192]. В степях заселяет участки с мягкими почвами и богатым травяным покровом. Редка в ковыльной и полынно-злаковой степи. В полупустыне населяет закрепленные пески, такыры, солонцы и долины рек. Избегает щебнистых и маломощных грунтов, а также увлажненных и очень засоленных территорий. Исходя из этого, в зоне Северного Казахстана слепушонка распространена спорадично и всюду редка. Но в местах, изобилующих корневищами, луковицами и клубнями растений, бывает многочисленной [116, с. 143].
Слепушонка ведет оседлый образ жизни, и ее перемещения по территории вызваны лишь неблагоприятными изменениями в условиях существования. Активность в основном сумеречная, на поверхность зверьки выходят очень редко и только на короткое время при выталкивании земли. Строят очень длинные и сложно устроенные норы. Каждая нора состоит из магистрального хода, длиною 100 м и более, расположенного на глубине 10–40 см, от которого идут боковые отнорки, длиной от 20 до 50 м. Гнездовые камеры и склады с запасами располагаются на глубине 1–4 метра. Норы, как правило, семейные, в одной норе могут жить до 10 особей. В зимнее время в спячку не впадает, но в период холодов, как и во время сильной жары, активность понижена. Слепушонка питается в основном подземными частями растений и относится к типичным корнеедам. Оказывая значительное механическое воздействие на почву, обогащает ее органическими веществами, способствуя проникновению в нее воздуха и влаги.
Вместе с этим наносит ущерб сельскому хозяйству, поедает урожай огородных культур (картофель, свеклу, бахчевые культуры и др.). Эпидемическое значение не выяснено [134, с. 343–344].
При благоприятных условиях способна размножаться во все сезоны [162, с. 201–202], но за год, вероятно, приносит не более 2–3 выводков, в каждом выводке бывает от 2 до 4 детенышей. В связи с большой продолжительностью жизни (до 6 лет) и ограниченностью жизненного пространства, у обыкновенной слепушонки наблюдается снижение репродуктивного потенциала, а также долгий предрепродуктивный период (по сравнению с другими грызунами таких же размеров). Таким образом, зверьки способны размножаться в возрасте одного года [186].
В зонах техногенной нагрузки обыкновенную слепушонку отлавливали в различных открытых биотопах с невысоким показателем численности: в полынной степи (Ф11, Ф12) – 0,6, разнотравно-типчаковой степи (И5, Б8) – 0,3, полынно-ковыльной (Б7) – 0,2, а в разнотравно-ковыльно-полынной степи (И4) – 0,1 особи на 100 к/с. Суммарное обилие обыкновенной слеушонки составило 0,2 особи на 100 к/с.
В популяции обыкновенной слепушонки на исследованной территории выявлено преобладание самок над самцами (53 % и 47 %). В мае и июне значительную часть населения составляли сеголетки (80 %, n=8), а перезимовавшие животные составляли 20 % (n=2). К середине и концу лета популяция полностью обновляется и перезимовавшие слепушонки, не встречаются.
По нашим данным средняя плодовитость обыкновенной слепушонки в зоне техногенной нагрузки составляла – 3,4 эмбриона (n=5), а максимальное их количество достигало четырех.
Красная полевка (Myodes rutilus Pall., 1779). Длина тела 85–120 мм, длина хвоста от 27 до 50 мм, но обычно не более 40 мм. Окраска верха изменчива, но, как правило, яркая с преобладанием красноватых или коричнево-красных тонов, часто обособленная от серой окраски боков в виде «мантии». Цвет боков серый, с палево-желтым оттенком. Брюшная сторона белесая, без примеси других тонов. Хвост большей частью отчетливо двухцветный: верх темно-коричниевый, низ палево-желтый. На всем протяжении хвост густо покрыт волосами, на конце кисточка из буро-коричневых волос [134, с. 407; 162, с. 169–170].
Вид, своим происхождением связан с Бореальным фаунистическим комплексом [182, с. 69]. По распространению красная полёвка относится к группе восточно-палеарктических видов [135, с. 191–192]. Ареал обширен. Охватывает всю лесную зону северной Евразии, включая побережья и острова дальневосточных морей. С древесной и кустарниковой растительностью проникает в лесотундру и тундру и поднимается в горы до верхнего предела леса. К югу идет до лесостепных районов Казахстана и Западной Сибири, горных лесов Северной Монголии, Северо-Восточного Китая, Кореи и северной Японии. В своем распространении красная полевка тесно связана с различными лесными и кустарниковыми ассоциациями. Конфигурация южной границы ее ареала определяется интразональными вклиниваниями древесной растительности в пустынную зону, особенно в Казахском нагорье, где зверьки далеко проникают на юг [162, с. 171–172].
В Павлодарском Прииртышье распространена повсеместно и многочисленна. Живет в сосняках, березово-осиновых колках, в поймах рек с зарослями кустарников, на лугах возле колков, в приозерных котловинах, в лесополосах, на полях. Зимой часто встречается в строениях человека [116, с. 142].
Красная полевка не строит нор в земле и для своих убежищ использует естественные укрытия и пустоты. Эта полевка бодрствует круглый год, ведя ночную жизнь. Очень привязана к избранному месту. В конце лета наблюдается расселение молодых зверьков. Питается семенами деревьев, ягодами, зеленью, грибами и животной пищей. Для красной полевки характерна сезонная смена кормов. В конце зимы – это преимущественно семена березы, в грибной сезон – грибы, осенью – ягоды.
К размножению красные полевки приступают в середине апреля и делают это в любую погоду. По-видимому, сигналом к размножению служит длина светового дня, а не температура воздуха. За период с апреля по сентябрь самка дает 5 пометов, в среднем по 8 детенышей в каждом [116, с. 142–143].
На территории техногенной нагрузки красная полевка встречена единожды в буферной зоне электролизного завода в полынно-ковыльной степи.
Степная пеструшка (Lagurus lagurus Pall., 1773). Размеры средние (длина тела до 120 мм). Хвост короче ступни (до 19 мм). Окраска верха от темной буровато-серой до светлой серовато-палевой. По спине от головы до основания хвоста проходит резко очерченная черная неширокая полоса [134, с. 424–425].
Степная пеструшка относится к Казахстано-Европейскому фаунистическому комплексу [178, с. 417–419; 182, с. 69]. Распространена она в лесостепи, степи и северной полупустыни Старого Света, от Приднепровья на западе до приалтайских, приенисейских и прибайкальских на востоке, в Хакасии встречается изолировано. Встречается в западной части Монголии и Северо-Западном Китае [134, с. 424].
В Северном Казахстане распространена повсеместно. Занимает злаково-разнотравные, злаковые, злаково-полынные степи и посевы. В засушливые годы переселяется на пониженные участки рельефа, речные долины и озерные котловины [116, с. 147].
Пеструшка привязана к своим убежищам и живет оседло. Однако, в годы массовой вспышки их численности, зверьки совершают дальние миграции. Живут они семьями, в которых обычно бывает пара взрослых – самец и самка и неполовозрелые молодые [116, с. 147].
Степная пеструшка меньше, чем другие виды мелких полевочьих нуждается во влажном корме, предпочитает узколистные злаки, полыни. В засушливых условиях поедает также клубни и луковицы, а иногда животную пищу (саранчовые). Зимние запасы не характерны. В благоприятные годы приносит до 6 пометов, а прибылые самки до 1–2 пометов. В помете бывает в среднем 5–6 детенышей, а максимальное их число 10–14. В теплые и кормные зимы на востоке ареала известны случаи подснежного размножения. Численность меняется по годам более резко, чем у других мелких полевочьих [134, с. 425–426]. В зоне степей каждые 3–5 лет бывают бесснежные морозные зимы, приводящие к гибели зверьков в их неглубоких подземных жилищах. Так же к гибели пеструшек приводят теплые зимы с оттепелями, и весенние половодья. Все эти факторы вместе с циклическими засухами приводят к массовой элиминации зверьков. Череда благоприятных зим способствует массовой вспышке численности степной пеструшки и ее миграциям [116, с. 148].
В зонах техногенной нагрузки степную пеструшку с невысоким показателем численности отлавливали в следующих биотопах: полынно-ковыльной (Б7) – 0,4, разнотравно-ковыльно-полынной (И3, И4) и типчаково-полынной степи с элементами древесной растительности (Б6, Ф9, Ф10) – по 0,2, а также в полынной степи (Ф11) – 0,1 особи на 100 к/с. Суммарное обилие составило 0,14 особи на 100 к/с.
В популяции степной пеструшки в окрестностях г. Павлодар выявлено преобладание самцов над самками (79 % и 21 %). Среди разных возрастных групп значительное превышение доли самцов над самками отмечено у перезимовавших зверьков и половозрелых сеголеток (100 % и 83 % соответственно), а в сообществе неполовозрелых сеголеток самки превалируют над самцами, но с относительно меньшей долей (67 % к 33%).
С мая по июль в популяции степной пеструшки преобладают перезимовавшие зверьки и половозрелые сеголетки (86 %, n=6), из них 71 % приходится на самцов. В конце лета и осенью соотношение возрастных групп выравнивается. На долю половозрелых сеголеток приходится 43 % (n=3), немного уступают им перезимовавшие животные и неполовозрелые сеголетки (по 29 %).
В наших уловах беременная самка с пятью эмбрионами единично была встречена в импактной зоне КЭЗ (И4), в разнотравно-ковыльно-полынной степи.
Узкочерепная полевка (Microtus gregalis Pall., 1779). Длина тела до 125 мм у мелких форм и до 132 мм у крупных, длина хвоста до 27 мм у короткохвостых и до 40 мм у длиннохвостых форм соответственно. Окраска верха от светло-охристой до темно-бурой, с характерной пестриной от смеси темных и светлых окончаний волос. На затылке и в передней части спины имеется размытая черная продольная полоса, особенно у молодых особей. Брюшная поверхность светло-серая. Хвост двухцветный, его концевые волосы удлинены [134, с. 476].
Узкочерепная полевка относится к Казахстано-Европейскому фаунистическому комплексу [176, с. 414; 182, с. 69]. На основании сходных экологических черт, свойственных степным видам животных, В. В. Кучерук (2006) относит её к горно-тундрово-степным формам со степным центром происхождения [178, с. 412–414].
Ареал вида охватывает тундровую зону – от европейского Севера и западного Приуралья на западе до Анадырского края на востоке. На юге ареал охватывает лесостепные и степные части Сибири, Казахстана, Средней Азии, Северной и Центральной Монголии, и северо-запада Китая [135, с. 208–209]. В Павлодарском Прииртышье это обычный вид, но наиболее многочислен он в местах с увлажненной почвой и пышным травостоем. Наиболее охотно заселяет увлажненные луга, степи, участки густого травостоя и кустарников, а также колки. Зимой зверьки скапливаются по зарослям бурьяна, у колков, по краям полезащитных полос, где накапливается много снега, защищающего ее норы и подснежные зимовочные гнезда от сильного промерзания [116, с. 149].
Вид тесно связан в своём распространении с открытыми участками, занятыми ксерофитными растительными сообществами, что нашло отражение в морфологических, физиологических и поведенческих особенностях.
Эта полевка роет сложные норы, имеет примитивную звуковую сигнализацию и ведёт общественный образ жизни, что помогает сглаживать мощный пресс со стороны хищников-миофагов [187]. Являясь исключительно зеленоядной формой, узкочерепная полевка отдает предпочтение более калорийным злаковым и бобовым культурам [162, с. 356].
В зонах техногенной нагрузки узкочерепную полевку чаще всего отмечали в типчаково-полынной степи с элементами древесной растительности (Б6, Ф9, Ф10) – 2,3 особи на 100 к/с. Несколько меньше ее обилие в полынно-ковыльной (Б7) – 0,6, разнотравно-полынной степи с элементами древесной растительности (И1, И2) – 0,3, а также в разнотравно-ковыльно-полынной (И4) и полынной степях (Ф11) – по 0,1 особи на 100 к/с. Суммарное обилие узкочерепной полевки составило 0,7 особи на 100 к/с.
В популяции узкочерепной полевки в окрестностях г. Павлодар выявлено преобладание самцов над самками (59 % и 41 %). Среди разных возрастных групп их соотношение меняется. Так у перезимовавших животных и половозрелых сеголеток доли самцов и самок имеют почти равные значения (50 % и 48% соответственно), а среди неполовозрелых сеголеток самцы заметно превалируют над самками (67,5 % и 32,5 %).
Доля взрослых перезимовавших животных в течение всего года очень незначительна, так, в мае, июле и августе, их общая доля в отловах составила всего 6 % (n=4). В мае и в июне в популяции узкочерепной полевки преобладают сеголетки (94 %, n=34), среди которых на долю половозрелых и неполовозрелых зверьков приходится по 50 % (n=16). К середине лета резко увеличивается доля неполовозрелых сеголетков, суммарная доля которых составляет 70 % (n=16), а участие половозрелых молодых не превышает 26 % (n=6). Основу населения узкочерепной полевки в конце лета и осенью составляют неполовозрелые сеголетки (58 %), среди которых доминируют самцы (65 %) (рисунок 9).
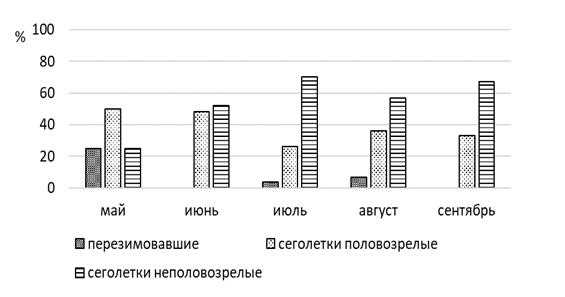
Размножается узкочерепная полевка в течение всего теплого времени года. За сезон размножения самки приносят до 4–5 выводков. Беременность длится 18–20 дней. В каждом помете количество детенышей колеблется от 4 до 13. Половая зрелость наступает рано, прибылые самки размножаются, едва достигнув четверти веса взрослой самки [116, 149–150].
В зоне техногенной нагрузки беременные самки встречались с середины мая до начала июня. Средняя плодовитость составляла – 7,6 эмбрионов (n=14), а максимальное их количество равнялось девяти.
Полевка-экономка (Microtus oeconоmus Pall., 1776). Наиболее крупная полевка после ондатры и водяной полевки с длиной тела до 150 мм. Передние и задние конечности относительно короткие, одинаковой длины. Уши небольшие. Хвост достигает более одной трети туловища, ясно двухцветный. Верх тела темный, буро-коричневый, брюшная сторона серебристо-серая [162, с. 411–412].
Полевка-экономка относится к Бореальному фаунистическому комплексу [182, с. 69]. Она распространена в северной и средней частях Европы, в Сибири ее ареал идет на восток до Анадыря, Камчатки и Курильских островов, в Монголии, Китае, Северной Америке (Аляска, Западная Канада) [135, с. 206–207]. В Павлодарском Прииртышье имеются локальные поселения этой полевки на северо-востоке в лесостепной зоне. Предпочитает заселять влажные участки в лесной и прилегающих к ней зонах с древесно-кустарниковыми зарослями по речным долинам и другим понижениям рельефа, где живут в тростниковых займищах по берегам озер. Здесь полевка обычна, местами многочисленна [116, с. 151].
Активность круглогодичная и круглосуточная, с максимумом в сумеречные часы. Свои гнезда устраивает в норах, но реже – на поверхности земли под укрытием кустов или дерновин, среди тростника. Зимой строит подснежные гнезда на земле, либо в толще снега. Экономка хорошо и быстро плавает, ныряет, преодолевая значительные водоемы [162, с. 415]. Питается зелеными частями лесных и болотных трав, а также корой деревьев и кустарников, их семенами и ягодами. Поедает и животную пищу [116, с. 152].
Размножение начинается с таянием снега, чаще всего в апреле, а заканчивается в зависимости от зональных особенностей климата и характера осени – в августе-ноябре. Перезимовавшие самки приносят до четырех пометов, прибылые первого выводка участвуют в размножении чаще всего один или два раза, реже три. В помете бывает от 6 до 7 детенышей. Численность подвержена значительным колебаниям и во многом зависит от погодных условий весны [162, с. 415–417].
В зонах техногенной нагрузки полевка-экономка была встречена лишь в типчаково-полынной степи с элементами древесной растительности (Ф9, Ф10) с невысоким показателем численности – 0,14 особи на 100 к/с. Суммарное обилие полевки составило 0,04 особи на 100 к/с.
В населении полевки-экономки в окрестностях г. Павлодар были встречены исключительно самцы разных возрастных групп (n=4).
Обыкновенная полевка (Microtus arvalis Pall., 1779). Длина тела
80–140 мм, хвост около трети длины туловища. Окраска спины от светло-серой до темно-бурой. Хвост обычно одноцветный или слабо двухцветный [134, с. 493].
Обыкновенная полевка по происхождению относится к Европейскому фаунистическому комплексу, по характеру современного распространения ее относят к типичным западным палеарктам [173, с. 67; 182, с. 69]. Ареал охватывает всю Европу, Казахстан, Западную Сибирь на восток до Алтая, Синьцзяна и севоро-запада Монголии [135, с. 207; 180, с. 366]. Населяет эта полевка пойменные луга, окраины полей, сады и огороды, парки и пустыри в городах, балки и другие достаточно влажные понижения в степных областях. По остепненным склонам гор она поднимается до субальпийских лугов на высоте 2000–2500 метров, а по приречным тугайным зарослям проникает в полупустыни [180, с. 366]. В Павлодарском Прииртышье распространена повсеместно [116, с. 150].
Обыкновенная полевка селится колониями, роет неглубокие норы, в период высокой численности образует поселения со многими сотнями выходов. После уборки урожая поселяется в скирдах, ометах, гумнах, иногда в жилых постройках. Летом питается зелеными частями травянистых растений, зимой – их подземными частями. При благоприятных условиях дает до семи приплодов в год, в каждом от 4 до 6 (иногда до 12) детенышей [135, с. 207].
В зонах техногенной нагрузки обыкновенную полевку с невысоким показателем численности отлавливали в трех биотопах. Наибольшее ее обилие отмечено в разнотравно-полынной степи с элементами древесной растительности (И1, И2) – 0,5, и значительно меньше в разнотравно-типчаковой степи (И5) – 0,1 особи на 100 к/с. Меньше всего обыкновенной полевки отмечено в типчаково-полынной степи с элементами древесной растительности (Б6, Ф9) – 0,07 особи на 100 к/с. В целом по зоне техногенной нагрузки обилие обыкновенной полевки составило 0,01 на 100 к/с.
В популяции обыкновенной полевки в окрестностях г. Павлодар выявлено преобладание самцов над самками (62 % и 38%). Среди отловленных животных преобладали сеголетки неполовозрелые (75 %), из которых 56 % приходилось на самцов.
Восточноевропейская полевка (Microtus levis Miller, 1908). Это вид-«двойник» обыкновенной полевки, который по «традиционным» признакам не отличим от нее (различия – в строении хромосом). В отличие от большинства других групп видов-«двойников», ареалы у которых только соприкасаются, у этой пары они широко налегают один на другой в Европе. Более того, в большинстве мест они живут летом на одних и тех же полях, а зимой в одних и тех же скирдах.
Тем не менее, эти два вида четко отличаются особенностями образа жизни. Так восточноевропейская полевка более сухо- и холодолюбива, в ее рационе преобладают зерновые, а не зеленые корма. Зверьки этого вида реже делают запасы на зиму. Они не очень агрессивны и свободно бегают по всей колонии, заныривая в разные норы [180, с. 207].
По нашим данным в зонах техногенной нагрузки восточноевропейская полевка встречена лишь единожды в разнотравно-полынной степи с элементами древесной растительности (И1).
Мышь-малютка (Micromys minutus Pall., 1771). Длина тела 50–70 мм, масса тела не более 10 г. Мордочка притуплена, глаза небольшие, ушная раковина с хорошо развитым противокозелком. Подошвенные мозоли на ступне вытянуты в длину. Хвост приблизительно равен длине тела, очень подвижен и способен обвиваться вокруг стеблей и тонких сучьев. Мех мягкий, остевые волосы длинные и тонкие [135, с. 215]. Окраска однотонная, двухцветная: верх – от яркой оранжево-рыжей до коричневой, темной, брюшко белое, иногда с легким сероватым налетом, граница между окраской низа и верха резкая [161, с. 446]. Череп с укороченным лицевым и крупным мозговым отделами, без гребней [135, с. 215].
Мышь-малютка относится к Евро-Маньчжурскому фаунистическому комплексу [170, с. 14; 182, с. 69]. Ареал вида простирается от тихоокеанского побережья России и Китая до атлантического побережья Европы [180, с. 430]. Обитатель лесов, лесостепей и степей. В Павлодарской области распространена повсеместно, и на большей части территории обычна. Населяет влажные и увлажненные места с густой высокорослой травянистой и кустарниковой растительностью [116, с. 132].
В холодное время года живет в просто устроенных норах, летом строит круглые гнезда на травянистых растениях и кустарниках (на высоте 40–100 см), реже на земле. Осенью и зимой переселяется в скирды. Ловко лазает по стеблям злаков, помогая себе хвостом. За лето приносит 2–3 выводка, до 12 детенышей в каждом. Питается семенами трав [116, с. 132–133].
В районе исследований мышь-малютка встречена однократно на восточной фоновой территории в типчаково-полынной степи с элементами древесной растительности (Ф10).
Малая лесная мышь (Apodemus uralensis Pall., 1811). Длина тела до 100 мм, хвост приблизительно равен длине тела. Длина ступни менее 23 мм. Меховой покров на спинной стороне мягкий. Окраска верха тела довольно темная буровато-серая [135, с. 219].
Малая лесная мышь относится к Европейскому фаунистическому комплексу [170, с. 14; 182, с. 69]. Широко распространена в Восточной Европе, Турции, на Кавказе, в Северном и Восточном Казахстане, в горных лесах средней Азии, на Алтае, в Северном Синьцзяне. Обитатель смешанных и широколиственных лесов; по заросшим ручьям и балкам проникает в безлесные районы [135, с. 219].
Период активности приходится преимущественно на сумеречные и ночные часы. Хорошо лазает по деревьям. Селится в естественных убежищах, особенно в дуплах, часто расположенных на значительной высоте. Нередко, особенно в степной зоне, роет также и норы, большей частью под корнями деревьев, обычно не сложного строения. Основная пища – семена, особенно древесных пород, ягоды и животные корма (в основном насекомые) и на последнем месте зеленые части растений. Могут размножаться круглый год, особенно интенсивно с апреля по август. Число выводков у перезимовавших самок 2–4, у первых сеголетков 1–2, в каждом чаще всего по 5–7 детенышей [134, с. 289].
В зонах техногенной нагрузки малую лесную мышь однократно отлавливали в импактной зоне алюминиевого завода (И1), расположенной в разнотравно-полынной степи с элементами древесной растительности и трижды на фоновой территории (Ф9) в типчаково-полынной степи с элементами древесной растительности, с одинаково невысоким показателем численности (0,1 особи на 100 к/с). В целом по району исследований суммарное обилие малой лесной мыши составило 0,04 особи на 100 к/с. Все пойманные зверьки были неполовозрелыми сеголетками (n=4).
4.2 Население мелких млекопитающих в зонах техногенной нагрузки алюминиевого производства
4.2.1 Характеристика населения мелких млекопитающих зон техногенной нагрузки и контрольной территории
Всего проанализировано 508 особей мелких млекопитающих 19 видов, 11 родов, 5 семейств и 2 отрядов. Среди отловленных животных преобладали грызуны, как в техногенной (88 %), так и в контрольной (67 %) зонах (таблица 4). Количество видов, отмеченных в зоне техногенной нагрузки – 16, в контрольной зоне (КК) – 13. Малая белозубка и обыкновенная слепушонка в Карасукском районе не встречаются [123, с. 236].
Из семейства Беличьих (Sciuridae Fischer, 1817) в ловчие канавки в зонах техногенной нагрузки ловился краснощекий суслик (Spermophilus erythrogenys, Brandt, 1841), но так как использованная методика не совсем точно отражает сведения об его обилии, в анализ он не включен.
Показатель суммарного обилия мелких млекопитающих в среднем по всем зонам техногенной нагрузки в период массового размножения был весьма низок (2,3 особи на 100 к/с), в то время как на контрольной территории численность выше в восемь раз и составляет 17,5 особи на 100 к/с.
Таблица 4 – Видовой состав и численные характеристики населения мелких млекопитающих зоны техногенной нагрузки и контрольной территории
|
Вид |
Зона техногенной нагрузки |
Контрольная зона (КК) |
||||
|
n |
п.ч. |
и.д. |
n |
п.ч. |
и.д. |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Насекомоядные (Insectivora) |
||||||
|
Малая белозубка (Crocidura suaveolens Pall., 1811) |
8 |
0,08 |
3,3 |
- |
- |
- |
|
Обыкновенная бурозубка (Sorex araneus L., 1758) |
2 |
0,02 |
0,8 |
23 |
1,5 |
8,6 |
|
Тундряная бурозубка (S. tundrensis Merriam, 1900) |
15 |
0,15 |
6,3 |
41 |
2,7 |
15,3 |
|
Средняя бурозубка (S. caecutiens Laxmann, 1785) |
- |
- |
- |
1 |
0,07 |
0,4 |
|
Крошечная бурозубка (S. minutissimus Zimmermann, 1780) |
1 |
0,01 |
0,4 |
- |
- |
- |
|
Малая бурозубка (S. minutus L., 1766) |
3 |
0,03 |
1,3 |
24 |
1,6 |
9 |
|
Грызуны (Rodentia) |
||||||
|
Степная мышовка (Sicista subtilis Pall., 1773) |
56 |
0,54 |
23,3 |
- |
- |
- |
|
Джунгарский хомячок (Phodopus sungorus Pall., 1773) |
23 |
0,22 |
9,6 |
2 |
0,1 |
0,7 |
|
Обыкновенная слепушонка (Ellobius talpinus Pall., 1770) |
18 |
0,2 |
7,5 |
- |
- |
- |
|
Красная полевка (Myodes rutilus Pall., 1779) |
1 |
0,01 |
0,4 |
- |
- |
- |
|
Степная пеструшка (Lagurus lagurus Pall., 1773) |
14 |
0,14 |
5,8 |
1 |
0,07 |
0,4 |
|
Водяная полевка (Arvicola amphibius L., 1758) |
- |
- |
- |
1 |
0,07 |
0,4 |
|
Узкочерепная полевка (Microtus gregalis Pall., 1779) |
76 |
0,74 |
32 |
119 |
7,8 |
44,4 |
|
Полевка-экономка (M. oeconоmus Pall., 1776) |
4 |
0,04 |
1,7 |
9 |
0,6 |
3,4 |
|
Обыкновенная полевка (M. arvalis Pall., 1779) |
13 |
0,13 |
5,4 |
- |
- |
- |
|
Восточноевропейская полевка (M. levis Miller, 1908) |
1 |
0,01 |
0,4 |
8 |
0,5 |
3 |
|
1 |
0,01 |
0,4 |
28 |
1,8 |
10,4 |
|
|
Малая лесная мышь (Apodemus uralensis Pall., 1811) |
4 |
0,04 |
1,7 |
2 |
0,1 |
0,7 |
|
Полевая мышь (A. agrarius Pall., 1771) |
- |
- |
- |
9 |
0,6 |
3,4 |
|
Всего |
240 |
2,3 |
100 |
268 |
17,5 |
100 |
На контрольной территории самые высокие показатели численности отмечены у узкочерепной полевки (7,8 особи на 100 к/с), тундряной и малой бурозубок (1,6–2,7 особи на 100 к/с), а также у мыши-малютки (1,8 особи на 100 к/с). В зоне техногенной нагрузки у доминирующих видов показатель численности намного ниже: у узкочерепной полевки – 0,74 особи на 100 к/с, у степной мышовки – 0,54 особи на 100 к/с, а у джунгарского хомячка – 0,22 особи на 100 к/с.
Структура доминирования мелких млекопитающих на всех пробных участках зон техногенной нагрузки характеризуется нарушенностью и значительной монодоминантностью [130,
с. 795–796]. Больше половины всего населения здесь занимают узкочерепная полевка, степная мышовка и джунгарский хомячок (32 %, 23 % и 10 %), а на долю остальных видов приходится всего 35 %. На контрольной территории структура доминирования характеризуется большей выравненностью. Доминирует здесь также узкочерепная полевка (44 %). Содоминируют тундряная бурозубка и мышь-малютка (15 % и 10 %), и совсем немного уступают им обыкновенная и малая бурозубки (по 9 %). По сравнению с Карасуком, сообщества мелких млекопитающих Павлодарского участка отличаются низким обилием насекомоядных зверьков, на долю которых приходится 12 %, что является следствием аридности данной территории и обедненности кормовой базы [132, с. 16].
4.2.2 Распределение мелких млекопитающих по зонам техногенной нагрузки.
При сравнении фоновых, буферных и импактных участков, наблюдается тенденция уменьшения видового разнообразия по мере приближения к источникам загрязнения (таблица 5). Суммарное обилие и распределение мелких млекопитающих на всех территориях техногенного воздействия неравномерное.
Таблица 5 – Структура населения мелких млекопитающих в зонах техногенной нагрузки с учетом наветренной и подветренной сторон (Н – наветренная, П – подветренная стороны)
|
Исследованные показатели |
Зоны техногенной нагрузки |
|||||||||||||||
|
фоновая |
буферная |
импактная |
||||||||||||||
|
Участки |
Ф11, Ф12 (П) |
Ф9, Ф10 (Н) |
Б8 (П) |
Б7 (Н) |
Б6 (П) |
И5 (П) |
И3, И4 (Н) |
И1, И2 (Н) |
||||||||
|
Отработано конусо-суток |
1810 |
1805 |
700 |
855 |
955 |
705 |
1760 |
1702 |
||||||||
|
Отловлено животных, экз. |
24 |
61 |
1 |
35 |
43 |
19 |
35 |
22 |
||||||||
|
Зарегистрировано видов |
7 |
12 |
1 |
8 |
6 |
6 |
5 |
8 |
||||||||
|
Насекомоядные |
||||||||||||||||
|
Вид |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
|
Малая белозубка |
- |
- |
6,6 |
0,2 |
- |
- |
- |
- |
2,3 |
0,1 |
- |
- |
2,9 |
0,1 |
9,1 |
0,1 |
|
Обыкновенная бурозубка |
- |
- |
- |
- |
- |
- |
2,9 |
0,1 |
- |
- |
5,3 |
0,1 |
- |
- |
- |
- |
|
Тундряная бурозубка |
4,2 |
0,1 |
4,9 |
0,2 |
- |
- |
8,6 |
0,4 |
14,0 |
0,6 |
- |
- |
- |
- |
4,5 |
0,1 |
|
Крошечная бурозубка |
- |
- |
1,6 |
0,1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
0 |
0 |
|
Малая бурозубка |
4,2 |
0,1 |
1,6 |
0,1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4,5 |
0,1 |
|
Грызуны |
||||||||||||||||
|
Вид |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
и.д. |
п.ч |
|
Степная мышовка |
25 |
0,3 |
1,6 |
0,1 |
- |
- |
31,4 |
1,3 |
11,6 |
0,5 |
42,1 |
1,1 |
71,4 |
1,4 |
- |
- |
|
Джунгарский хомячок |
4,2 |
0,1 |
4,9 |
0,2 |
- |
- |
25,7 |
1,1 |
- |
- |
21,1 |
0,6 |
11,4 |
0,2 |
9,1 |
0,1 |
|
Обыкновенная слепушонка |
45,8 |
0,6 |
- |
- |
100 |
0,1 |
5,7 |
0,2 |
- |
- |
15,8 |
0,4 |
2,9 |
0,1 |
- |
- |
|
Красная полевка |
- |
- |
- |
- |
- |
- |
2,9 |
0,1 |
- |
- |
- |
- |
- |
- |
- |
- |
|
Степная пеструшка |
8,3 |
0,1 |
6,6 |
0,2 |
- |
- |
8,6 |
0,4 |
2,3 |
0,1 |
5,3 |
0,1 |
8,6 |
0,2 |
- |
- |
|
Узкочерепная полевка |
8,3 |
0,1 |
57,4 |
1,9 |
- |
- |
14,3 |
0,6 |
67,4 |
3,0 |
- |
- |
2,9 |
0,1 |
22,7 |
0,3 |
|
Полевка-экономка |
- |
- |
6,6 |
0,2 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Обыкновенная полевка |
- |
- |
1,6 |
0,1 |
- |
- |
- |
- |
2,3 |
0,1 |
10,5 |
0,3 |
- |
- |
41 |
0,5 |
|
Восточноевропейская полевка |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4,5 |
0,1 |
|
- |
- |
1,6 |
0,1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
Малая лесная мышь |
- |
- |
4,9 |
0,2 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4,5 |
0,1 |
|
Итого |
100 |
1,3 |
100 |
3,4 |
100 |
0,1 |
100 |
4,1 |
100 |
4,5 |
100 |
2,7 |
100 |
2,0 |
100 |
1,3 |
Так, на фоновых наветренных участках (Ф9, Ф10), характеризующихся меньшим влиянием от выбросов промышленных предприятий, население мелких млекопитающих представлено 12 видами, с общим показателем численности 3,4 особи на 100 к/с. Больше половины всего населения здесь занимает узкочерепная полевка (57,4 %). Существенная доля приходится на насекомоядных, представленных четырьмя видами (14,7 %). Только на этом участке техногенной нагрузки отмечены полевка-экономка, крошечная бурозубка и мышь-малютка. В то же время на подветренных участках (Ф11, Ф12), где вредное воздействие от выбросов выражено в большей степени, отмечено всего семь видов, а суммарное обилие составляет 1,3 особи на 100 к/с. Доминируют два вида – обыкновенная слепушонка (45,8 %) и степная мышовка (25 %).
В буферной зоне (Б6) алюминиевого завода размещенной на подветренной стороне в типчаково-полынной степи с элементами древесной растительности отмечено небольшое видовое богатство (6 видов) с нарушенной структурой доминирования. В сообществе мелких млекопитающих данного участка значительно преобладает узкочерепная полевка (67,4 %). Содоминантное положение занимают тундрянная бурозубка (14 %) и степная мышовка (11,6 %). Тундрянная бурозубка имеет здесь самые высокие показатели не только индекса доминирования, но и численности (0,6 особи на 100 к/с), чем на других территориях техногенной нагрузки. На долю остальных видов приходится по 2,3 % – это малая белозубка, степная пеструшка и обыкновенная полевка. Несмотря на значительное техногенное воздействие этого участка, плотность населения здесь выше, чем на фоновых территориях и сравнима только с контролем (4,5 особи на 100 к/с) (рисунок 10). Это может быть связано с тем, что буферный участок ПАЗ характеризуется наличием понижений в рельефе, густым и высоким травостоем, дающим мелким грызунам и насекомоядным достаточное количество корма и защитных укрытий. Настоящее еще раз подтверждает тот факт, что на подобных немногочисленных микроучастках складываются наиболее благоприятные условия для существования мелких млекопитающих [188, 189]. Кроме того, суммарное обилие может отражать характер межвидовых взаимодействий внутри сообществ, при этом реакция разных видов на одни и те же средовые градиенты может быть нетождественной.
Имактная зона (И1, И2) алюминиевого завода расположена с наветренной стороны от предприятия в разнотравно-полынной степи с элементами древесной растительности. Суммарное обилие мелких млекопитающих здесь сравнительно низкое – 1,3 особи на 100 к/с. Лидирующее положение, как по показателю численности, так и по доле в структуре населения здесь занимает обыкновенная полевка (0,5 особи на 100 к/с и 41 %). Содоминирует ей узкочерепная полевка (22,7%). Субдоминантное положение занимают джунгарский хомячок и малая белозубка, а на долю остальных видов приходится по 4,5 %, среди которых только на этом участке отмечена восточноевропейская полевка (таблица 5). Видовое богатство данного участка включает в себя восемь видов, что даже выше, чем на буферных и фоновых территориях, расположенных с подветренной стороны от алюминиевого завода. Данная особенность отмечена так же и для других районов. Так, результаты исследований, проведенных на Среднем Урале в районе медеплавильного завода, показали большее количество видов на техногенной территории, чем на контрольной, но в результате деградации естественных ландшафтно-экологических условий здесь уменьшилось суммарное обилие всех видов [78, с. 694].
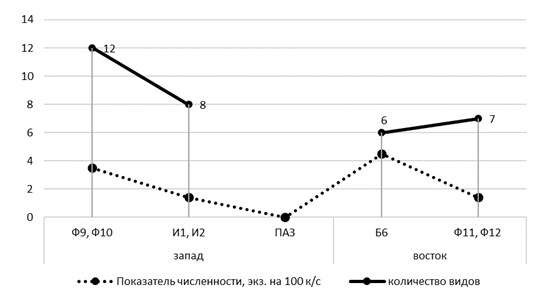
Характер изменения показателей численности животных от фоновых к импактным участкам в зоне действия выбросов Казахстанского электролизного завода, с учетом наветренной и подветренной сторон, представлен на рисунке 11.
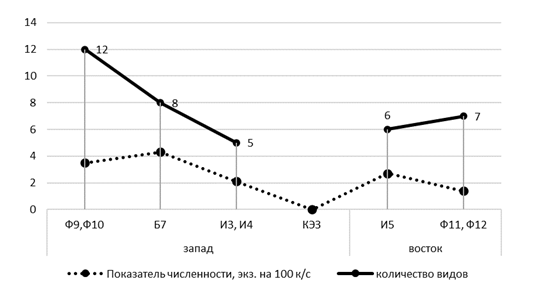
В буферной зоне КЭЗ (Б7), расположенной с наветренной стороны от завода отмечено восемь видов, что несколько меньше, чем на наветренных фоновых участках (Ф9, Ф10), но общий показатель численности достаточно высок – 4,1 особи на 100 к/с. Доминируют здесь степная мышовка (31,4 %), джунгарский хомячок (25,7 %) и узкочерепная полевка (14,3 %), незначительно уступают им степная пеструшка и тундряная бурозубка (по 8,6 %). Степная мышовка и джунгарский хомячок отмечены здесь с относительно высокими показателями не только индекса доминирования, но и численности (1,3 и 1,1 особи на 100 к/с), что несколько выше, чем на других территориях техногенной нагрузки. С подветренной стороны того же завода на пробном участке буферной зоны (Б8), расположенной в разнотравно-типчаковой степи, показатель численности самый низкий (0,1 особи на 100 к/с). Здесь за все время исследования встретился лишь один зверек – обыкновенная слепушонка, что, скорее всего связано с интенсивным выпасом скота и стоптанностью растительного покрова. В связи с очень низким обилием, при построении графика данный участок мы объединили с участком И5.
Импактные пробные участки (И3, И4) расположены с наветренной стороны от электролизного завода в разнотравно-ковыльно-полынной степи. Структура доминирования мелких млекопитающих характеризуется нарушенностью, что выражается в снижении суммарного обилия (2,0 особи на 100 к/с) и видового разнообразия (5) по сравнению с буферными и фоновыми участками. Здесь значительно преобладает степная мышовка (71,4 %), а на долю джунгарского хомячка приходится всего – 11,4 %. В качестве субдоминанта выступает степная пеструшка (8,6 %). Насекомоядные представлены лишь одним видом – малой белозубкой. В то же время, на подветренной стороне импактной зоны (И5) этого же завода, расположенной в разнотравно-типчаковой степи, отмечено шесть видов, с более высоким показателем численности – 2,7 особи на 100 к/с. Здесь также доминируют степная мышовка (42,1 %) и джунгарский хомячок (21,1 %), а также обыкновенная слепушонка (15,8 %) и обыкновенная полевка (10,5 %). Остальные виды, среди которых обыкновенная бурозубка и степная пеструшка, занимают второстепенное положение (по 5,3 %).
Нарушение структуры доминирования в сообществах мелких млекопитающих (рисунок 12) и их низкое суммарное обилие на техногенной территории указывает на низкую продуктивность этих местообитаний по сравнению с контролем. Схожая тенденция наблюдается и на территории Гиссарской долины в окрестностях Таджикского алюминиевого завода, Южно-Минусинской котловины в районе действия двух крупнейших алюминиевых заводов Саянского промышленного комплекса, а также Центрального Казахстана в районе Темиртауского промышленного комплекса [61, с. 150; 64, с. 8–11; 120, с. 23; 190].
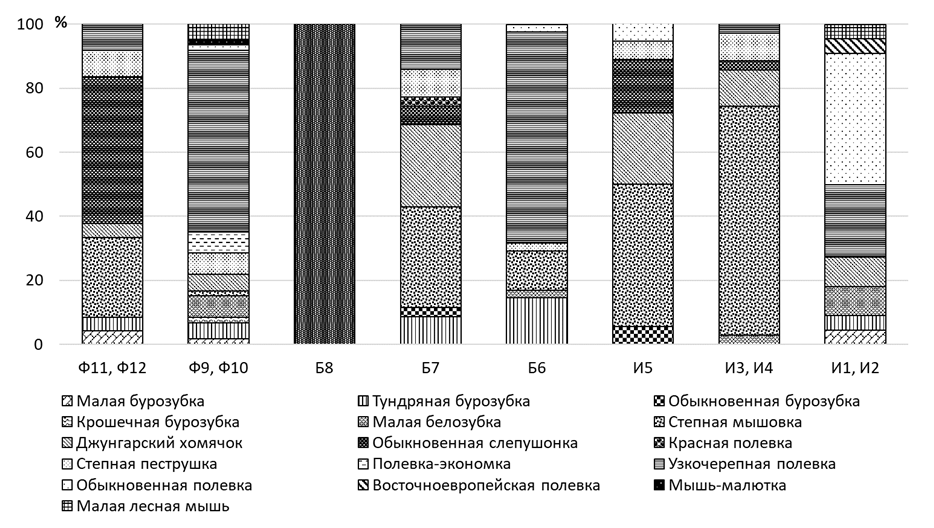
Узкочерепная полевка имеет самый высокий индекс доминирования в буферной зоне алюминиевого завода (Б6), на фоновых наветренных участках (Ф9, Ф10), и на контрольной территории, что вероятно связано с предпочитаемым этим видом относительно увлажненных открытых биотопов [162, с. 354]. Уменьшение индекса доминирования узкочерепной полевки отмечено в импактной (И1, И2) зоне алюминиевого и буферной зонах (Б7) электролизного завода, а на подветренных импактных и буферных участках этого же завода (И5 и Б8) эта полевка не встречена. Доминирующее положение в этих зонах Казахстанского электролизного завода занимает степная мышовка, которая предпочитает ковыльные степи с задернованной почвой. Так, в импактной зоне, расположенной с наветренной стороны от электролизного завода (И3, И4) степная мышовка – ярко выраженный доминант. Кроме того, данный вид отмечен на всех фоновых участках (Ф9-Ф12) и на буферном участке алюминиевого завода (Б6), но ее доля здесь значительно ниже. На контрольной территории степная мышовка за период исследований не встречена. Доля джунгарского хомячка наиболее высока в буферной (Б7) и импактной зонах (И3, И4, И5) электролизного завода, где он один из доминирующих видов. Меньшее обилие джунгарского хомячка отмечено в импактных участках алюминиевого завода (И1, И2), и еще меньше на фоновых территориях. Степной пеструшки существенно меньше. Субдоминантное положение она занимает в наветренном буферном участке (Б7), а также в наветренных (И3, И4) и подветренных (И5) импактных точках электролизного завода, и на фоновых территориях. Значительно меньше её на подветренном буферном участке алюминиевого завода (Б6). Полевка-экономка отмечена только на фоновых и контрольных площадках, но ее обилие повсеместно очень низкое. В первую очередь, это обусловлено приуроченностью вида к влажным пойменным биотопам в депрессиях рельефа с древесно-кустарниковой растительностью, которые не были охвачены нашими исследованиями. На наветренных импактных участках алюминиевого завода (И1, И2) существенную долю в сообществе мелких млекопитающих занимают обыкновенная полевка и малая белозубка. Так же эти два вида были встречены на фоновом наветренном участке (Ф9, Ф10) и в подветренной буферной зоне (Б6) алюминиевого завода.
Почти все участки техногенной зоны подвержены интенсивному выпасу скота, вследствие чего для этих территорий характерна низкая численность некоторых видов мелких млекопитающих, в том числе и обыкновенной слепушонки. Последняя по нашим данным преобладает лишь на фоновых подветренных участках (Ф11, Ф12) и в подветренной импактной зоне электролизного завода (И5), где она один из доминирующих видов. Изредка встречается эта слепушонка в наветренных буферном (Б7) и импактных участках электролизного завода (И3, И4), а на подветренном буферном участке этого завода (Б8) она единственный встреченный вид. По некоторым данным, пастбищная дигрессия может привести к вымиранию обыкновенной слепушонки, ведущей подземный образ жизни [178, с. 311–312]. Среди землероек на техногенной территории ведущее положение занимает тундряная бурозубка, которая встречена почти на всех исследуемых участках, за исключением импактных и буферных зон электролизного завода. Реже встречается малая белозубка, отмеченная также во всех трех зонах, а обилие обыкновенной, малой и крошечной бурозубок совсем незначительное. Низкая численность землероек на техногенной территории, а в особенности в импактных сообществах, обусловлено, прежде всего, деградацией кормовых ресурсов – почвенных беспозвоночных [68, с. 227]. Они чувствительны к загрязнениям как консументы более высокого порядка, имеющие к тому же высокий уровень метаболизма. В то же время на контрольной территории обилие насекомоядных значительно выше, а тундряная, малая и обыкновенная бурозубки занимают доминантное и субдоминантное положение.
Относительно высокие показатели индексов биоразнообразия и выравненности Симпсона (D и E) и Шеннона (H и J) характерны как для контрольных, так и для некоторых участков зон техногенной нагрузки, а именно фоновых участков, импактной зоны алюминиевого завода и буферной территории электролизного завода (рисунок 13).
Для фоновых и контрольных территорий характерны примерно одинаковые относительно высокие показатели индексов биоразнообразия и сравнительно высокое обилие видов. Высокие показатели индексов биоразнообразия импактной территории алюминиевого завода, можно объяснить тем фактом, что здесь отмечено сравнительно большое количество видов, но вследствие низких показателей численности каждого вида, их долевое участие в сообществах имеет почти равное значение, что приводит к высоким значениям индексов биоразнообразия и выравненности. Относительно высокое количество видов здесь, можно объяснить наличием древесной растительности и близостью жилых построек.
По этой же причине высокие показатели индексов биоразнообразия и выравненности характерны и для буферных участков электролизного завода.
Рисунок 13 – Значения информационных индексов биоразнообразия и выравненности Симпсона (D и E) и Шеннона (H и J)
Крайне неравномерно заселены импактные участки электролизного завода и буферные – алюминиевого завода, где отмечены самые низкие показатели индексов биоразнообразия и выравненности Симпсона (D и E) и Шеннона (H и J). Такие низкие значения обусловлены меньшим количеством видов в этих сообществах, а их долевое участие отличается крайней неоднородностью. Такое соотношение говорит о нарушенности этих местообитаний для большинства видов мелких млекопитающих, в результате чего в таких сообществах остаются наиболее толерантные виды к неблагоприятным внешним условиям, а численность остальных видов сводится к минимуму.
Таким образом, в целом по зоне техногенной нагрузки в сообществах мелких млекопитающих преобладают узкочерепная полевка, степная мышовка и джунгарский хомячок. Субдоминантное положение занимают обыкновенная слепушонка, степная пеструшка и тундряная бурозубка, а доли остальных видов незначительны. При значительных техногенных нагрузках структура доминирования мелких млекопитающих характеризуется низкой выравненностью и преобладанием одного или двух видов в сообществе. Так, на импактных территориях Павлодарского алюминиевого завода абсолютно преобладают обыкновенная и узкочерепная полевки, а в наветренных импактных зонах Казахстанского электролизного завода – степная мышовка. На буферных участках алюминиевого завода доминирует узкочерепная полевка, а на буферной территории электролизного завода степная мышовка и джунгарский хомячок. На фоновых территориях с восточной и западной стороны – это обыкновенная слепушонка и узкочерепная полевка, соответственно.
Показатель суммарного обилия мелких млекопитающих в среднем по всем зонам техногенной нагрузки в период массового размножения был значительно ниже, чем на контрольной территории. По мере удаления от источников загрязнения меняется не только структура населения мелких млекопитающих, но также их суммарное обилие и видовое богатство. Плотность населения и количество видов имеет тенденцию снижения от фоновых к импактным территориям, т.е. по мере приближения к источникам выбросов, при этом на подветренных участках эти показатели, как правило, ниже, чем на наветренных. Изменения показателей индексов видового разнообразия и выравненности имеют иной характер. Так, на импактных территориях Казахстанского электролизного завода население мелких млекопитающих можно охарактеризовать, как малочисленное с обедненным видовым составом и с нарушенным распределением видов в сообществах. В буферных зонах этого же завода условия для жизнедеятельности мелких млекопитающих более благоприятные, что выражается в более высоких показателях суммарного обилия и видового богатства и как следствие в более высоких индексах видового разнообразия и выравненности. Характер изменения индексов видового разнообразия в районе воздействия Павлодарского алюминиевого завода от импактных к фоновым территориям не линеен. В импактных территориях алюминиевого завода видовое разнообразие и выравненность, за счет большего количества видов, достигают более высоких показателей, чем в буферных участках, однако суммарное обилие здесь ничтожно низкое. На фоновых участках, в сравнении с буферными, показатели численности немного снижаются, но увеличивается видовое богатство, что приводит к повышению значений индексов видового разнообразия.
По сравнению с контрольной территорией, низкие показатели суммарного обилия мелких млекопитающих в зоне техногенной нагрузки, свидетельствуют о том, что трансформация среды приводит к образованию изолированных поселений с резким доминированием одного или двух видов. Сообщества мелких млекопитающих с подобной структурой доминирования отражают нарушения экологической емкости и структурированности среды. На контрольном участке отмечено более высокое суммарное обилие, а распределение большинства видов отличается большей выравненностью, что говорит, возможно, о меньшем влиянии антропогенной нагрузки.
4.3 Оценка воздействия выбросов алюминиевой промышленности на позвоночных животных
4.3.1 Накопление фтора в костной ткани доминирующих видов мелких млекопитающих в районе действия алюминиевого производства.
За последние годы особенно остро возникает проблема импактного (высоколокального) фторидного загрязнения экосистем на территориях, непосредственно прилегающих к предприятиям-загрязнителям [191, с. 7]. Одним из источников загрязнения фтором являются отходы и выбросы алюминиевого производства [192, 193]. О высокой загрязняющей способности говорит тот факт, что при производстве 1 т алюминия в атмосферу выбрасывается от 7 [191, с. 7] до 20 кг фтора [194]. Загрязнение территории микроэлементами определяется рассеивающей способностью атмосферы в отношении твердых частиц и зависит от объема выбросов, конфигурации, высоты и положения в рельефе источника выбросов, гранулометрического и химического состава пыли. Наиболее неблагоприятная обстановка складывается на расстоянии 0,5–1,5 км от заводов, твердые частицы с содержанием фтора оседают на расстоянии до 5 км, а газообразные соединения обнаруживаются в 30–50 км от источника [120, с. 17; 191, с. 21; 195–198].
Влияние неорганического фтора на живые организмы вызывает огромный интерес исследователей. Низкие концентрации потребления фтора неизбежно ведут к формированию и развитию кариеса. В связи с этим, согласно рекомендациям Всемирной организации здравоохранения, для профилактики заболеваний зубов и десен, во многих странах с начала 40-х годов ХХ в. соединения фтора добавляются в питьевую воду, молоко, соль, пищевые добавки, медикаменты, стоматологическую продукцию [29, с. 180; 199, 200]. Хотя споры о фторировании питьевой воды в Соединенных Штатах Америки продолжаются, 97 % стран Западной Европы отказались от фторирования воды. В центре дискуссии оказалось влияние фторированной воды на здоровье населения. На сегодняшний день хорошо известно токсическое влияние фтора на здоровье человека. В регионах с высоким содержанием фтора в окружающей среде, его хроническое избыточное поступление в организм человека и животных приводит к развитию флюороза, эндемического заболевания, характеризующегося патологическими изменениями в структуре, зубной и костной ткани [29, с. 180; 203, 204]. Увеличение содержание фтора в воздухе предприятий часто приводит к развитию хронических воспалительных реакций у рабочих – астме, кашлю, хроническому бронхиту, аллергии, кожным раздражениям [205, 206]. Люди, проживающие в зоне максимального воздействия фтора, подвергаются воздействию загрязнителя с одинаковой интенсивностью, что и рабочие, связанные с производством [207]. Концентрации фтора в костях могут варьировать от 50 мг/кг в ребре новорожденного до 1500 мг/кг в ребре больного флюорозом и с возрастом они только нарастают [208]. Более того граница между безопасными и токсичными дозами не определена. Мониторинг состояния водных и наземных экосистем показал, что растворимые соединения фтора накапливаются в растениях и животных и индуцируют развитие различных патологий, а также оказывают негативное влияние на здоровье человека [209–213].
Фтор загрязняет в первую очередь атмосферу, а через нее почву, воду и растения, меняет почвенно-геохимические условия среды обитания растительного и животного мира, и в конечном итоге снижает качество жизни населения [214, 215]. Загрязняющие вещества попадают в растения путем их поглощения преимущественно из воздуха через устьица и водных растворов через корневую систему, в меньшей степени из твердой фазы почв. К концу вегетационного периода содержание фтора в растениях увеличивается, а его концентрация зависит от видовой принадлежности и от внешних условий, при этом накопление фтора происходит главным образом в вегетативной массе. При воздействии фторидов на растения происходит нарушение минерального питания, деформация роста листа и внутренние повреждения листвы (хлороз, некроз тканей), карликовость, усыхание деревьев и ослабление иммунитета на атаки болезней и насекомых [196, с. 114–115; 216–218]. Геохимические исследования на территориях, подверженных интенсивному выбросу вредных веществ, показывают интенсивное накопление и превышение содержания фтора в соломе и травянистой массе в десятки раз, чем на фоновых территориях [61,
с. 147]. Содержание фторидов в кормовых культурах, особенно в люцерне, произрастающих на удалении 10 км от алюминиевого комбината, достигает 200 мг/кг. Более 80 % крупного рогатого скота, выращиваемого в этой зоне, страдают флюорозом, который проявляется стиранием резцов, истончением костей и резким падением продуктивности [219].
Аккумуляция фтора в растениях на загрязненных территориях оказывает существенное влияние на млекопитающих, прежде всего, травоядных и семеноядных [220]. Благодаря своей высокой реакционной способности, ион фтора может взаимодействовать с любой тканью живого организма и накапливаться в костях, зубах, волосах и ногтях.
Мелкие млекопитающие, обитающие вблизи источников выброса фтора, накапливают наиболее значительные его концентрации в костях. Показатели концентрации фтора в скелете различных видов животных отличаются. Так, в костях полевок (Microtus agrestis) и мышей (Apodemus sylvaticus), обитающих вблизи алюминиевого производства, концентрация фтора составила 910–11000 мкг/г и 1800–17200 мкг/г соответственно, в то время как на «чистых» территориях эти показатели в костях полевок были значительно ниже (23–540 мкг/г) [221]. Показатели концентрации фтора у домовых мышей (Mus musculus) вблизи алюминиевого завода варьируют от 5000 до 16000 мкг/г живого веса; у коровы черно-пестрой породы – от 6000 до 14000 мкг/г. Туркестанская крыса (Rattus turkestanicus) накапливает в костной ткани до 5900 мкг/г с проявлением симптомов флюороза, а в контроле от 580 до 1000 мкг/г. Уровень накопления фтора в скелете животных зависит, как от его количества, поступающего в организм, так и от физиологических процессов, связанных с его метаболизмом. При тех же уровнях накопления фтора в костях, при которых возникает поражение крупного рогатого скота, домовая мышь не обнаруживает признаков флюороза [190, с 11; 223]. Вблизи алюминиевого производства показатели содержания фтора в костях узкочерепной полевки (Microtus gregalis) составляли 860-2600 мг/кг, малой бурозубки (Sorex minutus) – 1600–3200 мг/кг, степной пеструшки (Lagurus lagurus) – 1140–3400 мг/кг, а ласки (Mustela nivalis) – 860 мг/кг. Эти различия в показателях в свою очередь определяются характером питания, содержанием фтора в кормах и возрастом животного. В осенний период происходит увеличение концентрация фтора, что связанно с накоплением этого элемента в растениях [61, с. 149]. С удалением от центра воздействия происходит снижение концентраций фтора в организме, возрастание видового разнообразия и общей биомассы животных [61, с. 150].
Экспериментальное содержание темной (M. agrestis) и рыжей полевок (Clethrionomys glareolus) и лесной мыши (A. sylvaticus) на воде, содержащей от 40 до 80 мг/л фтора, в течение 84 суток приводило к преждевременной смерти животных, а зубы выживших животных имели значительные морфологические изменения и повреждения [223]. Содержание самок полевок M. agrestis на диете с высокой концентрацией фтора, приводило к уменьшению числа пометов, снижению размера и веса потомства, увеличению смертности новорожденных. В то же время у самцов C. glareolus высокие дозы фтора приводили к повреждению тестикулярной ткани – геморрагии интерстиция, некрозу и апоптозу эпителия [224, 225].
Потребление фтора хищными животными фтора обычно незначительно, поскольку фтор накапливается преимущественно в костях жертв. Тем не менее, в костной ткани обыкновенных лисиц (Vulpes vulpes), обитающих на территориях, загрязненных фтором, показатели содержания этого элемента варьировали от 238 до 1650 мкг [226]. Выявлено, что хроническое потребление значительных количеств фтора вместе с пищей обыкновенными лисицами и американскими норками (Mustela vison) приводило к уменьшению продуцируемости у них молока, последующей смертности детенышей и снижению выживаемости потомства [227, 228].
В результате деятельности предприятий АО «Алюминий Казахстана» и АО «Казахстанский электролизный завод» в почвах г. Павлодар и его окрестностях сформировались ареалы концентрации фтора с максимальными показателями, превышающими фоновые значения в 492-847 раз (0,1 мг/кг) и предельно допустимые концентрации от 1,5 до 8,4 раз [23, с. 635-636; 24, с. 290]. Содержание фтора в почвах увеличивается по мере приближения к заводам. Наибольшие значения содержания фтора наблюдаются в импактных зонах обоих предприятий (14,5–15,3 мг/кг) и в буферной зоне электролизного завода (12 мг/кг), что превышает норму ПДК (до 10 мг/кг) [229] и фоновые значения на отдаленных участках (6,3 мг/кг). В буферной зоне алюминиевого завода содержание фтора в почве невысокое – 4,1 мг/кг [24, с. 290]. Скорее всего, такая разница связана с природными условиями территории, так как концентрация фтора в окружающей среде может значительно изменяться в зависимости не только от расстояния до источника эмиссий, но и от рельефа, структуры и свойств почвенного покрова, типа растительности, а также хозяйственного использования территории [193, с. 27–29].
До появления промышленного района Павлодарской области, естественный растительный покров территории был представлен разнотравно-дерновинно-злаковыми, типчаково-ковыльными сухими степями. В настоящее время здесь преобладают антропогенные модификации растительных ассоциаций [107, с. 20]. На отдельных территориях в радиусе 1,5 км от границы электролизного завода почвенный покров полностью разрушен или деструктурирован на [108, с. 16]. Увеличилась мозаичность местообитаний и гетерогенность ландшафтов.
Вокруг электролизного завода санитарно-защитная зона не имеет плотного лесного барьера (площадь озеленения – 34,0 га) [119, с. 1], который мог бы усваивать частично продукты загрязнения. Имеющиеся древесные насаждения, как правило, молодые и редкие, в отличие от окрестностей алюминиевого завода (площадь озеленения – 730 га; 62,84 тыс. древесно-кустарниковых пород) [117, с. 3]. Вследствие этого, за счет более дренированных почв, а также в связи с уклоном земной поверхности территории Павлодарской области с юга на север [230], загрязняющие вещества, в том числе и фториды, поступающие в почву, а далее в грунтовые и поверхностные воды могут быстрее вымываться со степных участков в сторону жилых поселков: Жетекши, Красноармейка, Шакат и др., а также в сторону уникального лечебного озера Мойылды. Понижение рельефа наблюдается от электролизного завода и в сторону п. Кенжеколь. Все это в перспективе может привести к ухудшению экологического состояния ландшафтов региона, растительного и животного мира, а также негативно сказываться на здоровье населения. Степные растительные сообщества способны накапливать и выносить высокие концентрации фтора, что делает опасным содержание скота в данных районах, из-за его потенциальной токсичности [195, с. 17; 231, 232]. Тем не менее, выпас скота интенсивно ведется на прилегающих территориях обоих заводов, что может приводить к повышению уровня фтора в организме животных, и как следствие в продуктах питания (молоке, мясе) [24, с. 293].
Анализ структуры сообществ мелких млекопитающих на техногенной территории показал, что больше половины всего населения здесь занимают узкочерепная полевка (31 %) и степная мышовка (23 %), а также относительно высока доля джунгарского хомячка (10 %) и степной пеструшки (6 %). Данные виды в сравнении с другими более равномерно распределены по зонам техногенной нагрузки. Поэтому для изучения содержания фтора в костной ткани были выбраны эти четыре вида. Аккумуляция фтора в костях грызунов разных видов независимо от участка отлова, происходит неодинаково. У узкочерепной полевки, степной мышовки и сеголетков джунгарского хомячка наблюдается тенденция линейного увеличения накопления фтора в костях, так же, как и в почве, по мере приближения к заводу. Пик концентрации фтора в данных случаях приходится на ближайшее расстояние от заводов.
Среднее содержание валового фтора в костях перезимовавших особей узкочерепной полевки на контрольной территории составило 22,3 мг/кг, а в буферной зоне этот показатель выше почти в три раза (63,2 мг/кг) (рисунок 14).
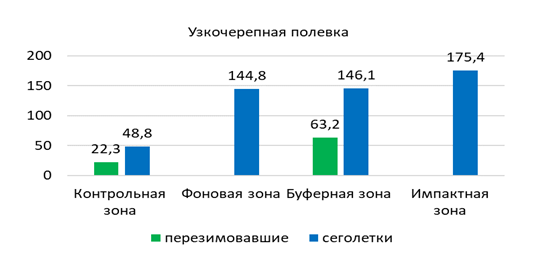
У сеголетков из фоновых (р˂0,01) и буферных зон, так же отмечено трехкратное увеличение среднего содержания фтора, по сравнению с контролем (48,8 мг/кг), но в свою очередь незначительное снижение по сравнению с импактным участком, где этот показатель составляет 175,4 мг/кг. Так же необходимо отметить, что максимальное содержание фтора у единичной особи зарегистрировано в буферной зоне алюминиевого завода (Б6) – 831,5 мг/кг, что может быть связано с тем, что данный участок располагался с подветренной стороны от источников выбросов. Кроме того, наличие в буферной зоне алюминиевого завода (Б6) древесно-кустарниковой растительности, может служить геохимическим барьером, в котором происходит накопление фтора.
У степной мышовки, как и у узкочерепной полевки наблюдается тенденция линейного увеличения содержания фтора в костной ткани по мере приближения к источникам выбросов (рисунок 15). Так, у сеголетков идет плавное увеличение содержания фтора в организме с 275,6 мг/кг на фоновой территории до 550,2 мг/кг в импактной зоне. В противовес этому у перезимовавших особей наблюдается резкий скачок, вследствие чего, содержание фтора в импактной зоне (1447 мг/кг) в три раза выше, чем в буферной (420 мг/кг). Более того у степной мышовки отмечена зависимость уровня накопления фтора в костной ткани от возраста животных. Так, у перезимовавших животных наблюдаются более высокие концентрации фтора, чем у сеголетков, причем в импактной зоне отмечено почти трехкратное превышение. Известно, что концентрации фтора в тканях животных с возрастом только нарастают [190, с. 16; 208, с. 282].
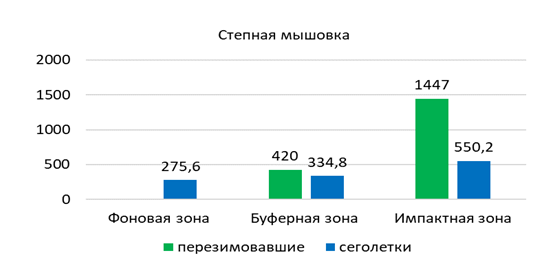
Также следует отметить, что среди анализируемых грызунов на предмет содержания фтора, у степной мышовки обнаружены самые высокие средние концентрации валового фтора в костной ткани – 2122,0 мг/кг (И5). Даже на фоновых территориях (Ф11, Ф12) значения фтора выше (275,6 мг/кг), чем у других видов животных, в том числе и с импактных зон. Более высокая концентрация фтора у степной мышовки может быть связана со смешанным характером питания этого вида. В отдельные сезоны года в питании степной мышовки могут преобладать животные корма [161, с. 157–158]. В то же время из литературы известно, что у насекомых фтор может накапливаться до критических значений. Так, на расстоянии 1 км от алюминиевого завода, содержание фтора в хитиновом покрове насекомых может быть выше в 17–35 раз, чем на контроле [233, 234]. Видимо поэтому максимальное содержание фтора в объединённой пробе костей степной мышовки наблюдается с подветренной стороны импактной зоны электролизного завода (И5), куда ветром может приносить насекомых. Содержание фтора там, у перезимовавших особей достигало 2122,1 мг/кг, а у сеголетков – 961,9 мг/кг. С наветренной стороны этого завода (И3, И4) содержание фтора значительно ниже – 772,5 и 344,3 мг/кг соответственно.
В отличие от первых двух видов, у перезимовавших особей джунгарского хомячка содержание фтора в костной ткани имеет большой разброс. Самые высокие значения наблюдаются в импактной (1049,8 мг /кг) и в фоновой (500,9 мг /кг) зонах, а минимальное – в буферной (142,9 мг/кг). Аналогичный большой разброс содержания фтора в костях отмечен у взрослых особей степной пеструшки. Самые высокие значения отмечены в буферной зоне (1196,5 мг/кг), значительно меньше в импактной (251,8 мг/кг), а минимум характерен для фоновой территории – 8,5 мг/кг. Только у сеголетков джунгарского хомячка наблюдается тенденция увеличения фтора в костях по мере приближения к заводу: в импактных зонах значения почти в 5 раз выше, чем на фоновых (254,0 и 54,4 мг/кг соответственно). Однако у сеголетков степной пеструшки, во всех трех зонах техногенной нагрузки отмечены практически одинаковые показатели (104,0–107,92 мг/кг) (рисунки 16, 17).
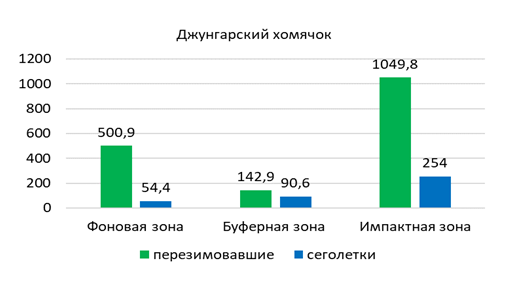
Аналогично, степной мышовке, у степной пеструшки и джунгарского хомячка, отмечена та же тенденция зависимости содержания фтора в костях от возраста животного. Однако характер накопления фтора у этих животных также не линеен в зависимости от градиента загрязнения и имеет большой разброс значений. Анализ показывает, что увеличение накопления фтора в организмах этих животных с приближением к источнику выбросов происходит не равномерно, а скачкообразно. С одной стороны, это может быть связано с недостаточной выборкой, но возможно и с природными условиями территории. Установлено, что накопление поллютантов зависит от удерживающих способностей почв и подстилающих пород, вследствие чего их содержание вдали от источника может быть значительно выше, чем вблизи его [61, с. 151].
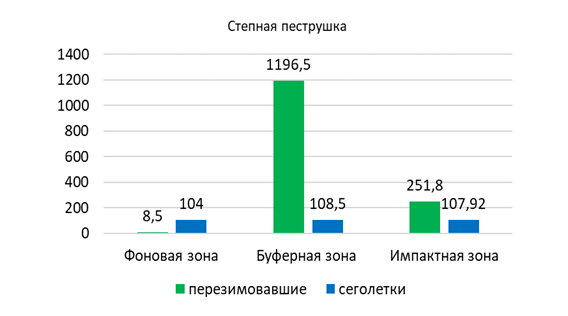
Показатели усредненного содержания фтора в костной ткани мелких млекопитающих на подветренных участках разных зон загрязнения, как правило, выше, чем на наветренных (рисунок 18).
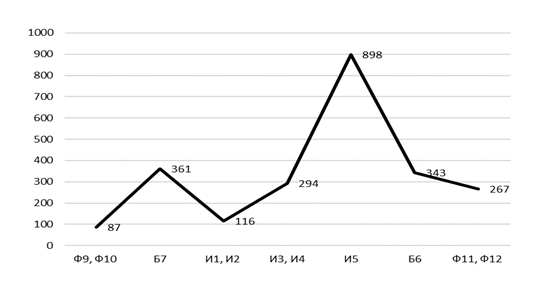
Ф9, Ф10, Б7, И1, И2, И3, И4 – наветренная сторона; И5, Б6, Ф11, Ф12 – подветренная сторона
Рисунок 18 – Усредненные показатели содержания фтора в костной ткани доминирующих видов грызунов в зависимости от наветренной и подветренной сторон (мг/кг)
При сравнении импактных зон, на подветренном участке (И5) содержание фтора в костной ткани грызунов достигает максимального значения, которое в 3–8 раз выше, чем на наветренных территориях (И1, И2, И3, И4). Также, на подветренных фоновых участках (Ф11, Ф12) содержание фтора выше в три раза, чем на наветренных (Ф9, Ф10). В то же время, наветренный участок буферной зоны (Б7) имеет относительно высокие значения содержания фтора по сравнению с наветренными импактными точками и даже несколько выше, чем на подветренном буферном участке (Б6). Скорее всего, это связано с расположением этого участка на одинаковом расстоянии между алюминиевым и электролизным заводами, а также аэропортом г. Павлодар. Усиленное воздействие этих предприятий, возможно, ведет к снижению толерантности и устойчивости животных, и как следствие к повышенным концентрациям фтора в организме. Именно на этом участке были встречены некоторые патологии у животных. Это опухоли на животе у джунгарского хомячка (n=2) и степной пеструшки (n=1), отростки в области анального отверстия и правостороннее расположение сердца у краснощекого суслика, а также отсутствие одной почки и одной фаллопиевой трубы у самки джунгарского хомячка. В импактной зоне электролизного завода отмечена деформация селезенки у джунгарского хомячка (n=3). По мнению многих авторов, в условиях перманентного загрязнения может происходить обеднение генетического разнообразия, увеличение мутационной нагрузки на популяции и снижение жизнеспособности популяции [235–237].
Такая же тенденция повышенного содержания фтора на подветренных участках по сравнению с наветренными, наблюдается на примере отдельных видов (рисунок 19).
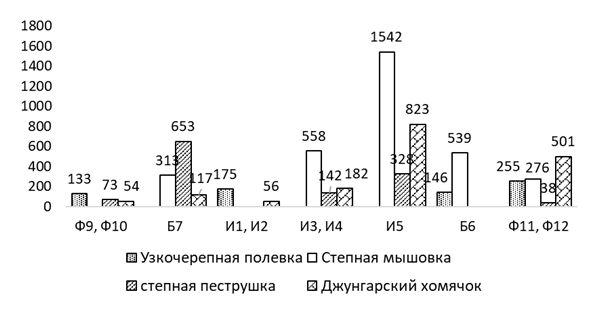
Ф9, Ф10, Б7, И1, И2, И3, И4 – наветренная сторона; И5, Б6, Ф11, Ф12 – подветренная сторона
Рисунок 19 – Накопление фтора в костях доминирующих видов мелких млекопитающих в зависимости от наветренной и подветренной сторон (мг/кг)
Так, на подветренной стороне импактной зоны (И5) показатели содержания фтора в костной ткани значительно выше, чем на наветренной стороне (И3, И4). У степной пеструшки эти показатели выше в два раза, у степной мышовки в три, а у джунгарского хомячка в 4,5 раза. Аналогичная тенденция наблюдается и на фоновых участках. Так, в костях узкочерепной полевки содержание фтора на фоновых территориях с подветренной стороны почти в два раза выше, чем на аналогичных участках, но с наветренной стороны (255 и 133 мг/кг соответственно). Такая же тенденция наблюдается и у джунгарского хомячка (501 и 54 мг/кг соответственно).
Дальнейшее увеличение мощностей алюминиевого производства Северного Казахстана прогнозируемо приведет к усилению техногенной нагрузки на окружающие экосистемы и увеличению концентраций фтора в почвах и в организме животных и человека. Так, в результате более длительного негативного воздействия алюминиевых заводов Саянского промышленного комплекса, Таджикского алюминиевого завода на экосистемы Южно-Минусинской котловины и Гиссарской долины, соответственно, произошло постепенное накопление вредных веществ во всех их компонентах и расширение общей зоны загрязнения. Эти накопления проявляются в аномально высоких концентрациях фтора в организмах животных даже на значительном расстоянии от заводов. В таких условиях в животных сообществах происходят структурные перестройки в сторону их упрощения, снижения общей биомассы и видового разнообразия. В силу высокой подвижности мелких млекопитающих локальное загрязнение может очень сильно повлиять на зверьков, обитающих на площади в сотни раз больше, чем площадь исходного загрязнения [61, с. 143–153; 120, с. 23–24; 190, с. 23–24; 214, с. 168–169].
Таким образом, техногенное воздействие алюминиевого производства города Павлодар приводит к накоплению фтора в организмах животных, при этом в различных зонах техногенной нагрузки фтор в костных тканях грызунов аккумулируется неодинаково. Самые высокие средние концентрации валового фтора обнаружены у степной мышовки. У узкочерепной полевки, степной мышовки и сеголетков джунгарского хомячка наблюдается тенденция линейного увеличения накопления фтора в костях, так же, как и в почве по мере приближения к заводу. Пик концентрации фтора в данных случаях приходится на ближайшее расстояние от заводов. Однако, у перезимовавших особей степной пеструшки, наоборот, содержание фтора в буферной зоне, выше, чем в импактной. У перезимовавших особей джунгарского хомячка максимальные значения наблюдаются на фоновой и импактной территориях и значительно меньше в буферной. Выявленная нами тенденция снижения уровня численности мелких млекопитающих, обеднения видового состава и увеличения накопления фтора в костной ткани животных по мере приближения к заводам согласуются с данными по другим промышленным зонам алюминиевого производства.
В качестве наиболее подходящего биоиндикатора фторового загрязнения исследуемой территории можно рекомендовать узкочерепную полевку, что обусловлено ее относительно высокой численностью и встречаемостью практически на всех обследуемых участках. В районе электролизного завода, где отсутствует узкочерепная полевка, в качестве биоиндикатора может быть рекомендована доминирующая здесь степная мышовка.
4.3.2 Межпопуляционная морфологическая изменчивость узкочерепной полевки техногенной и контрольной территорий.
Известно, что влияние техногенных факторов загрязнения токсикантами и трансформация среды обитания являются одними из значимых внешних факторов, влияющих на изменение метаболизма животных. В таких условиях обитания, у животных происходит модификация процессов метаболизма, что выражается в изменении некоторых биохимических параметров организма, в том числе и их морфологической структуры. Могут наблюдаться уменьшения средней длины и массы тела [77, с. 22; 78, с 702].
Анализ экстерьерных признаков (массы, длины тела, ступни и хвоста) узкочерепной полевки (таблица 6, рисунки 20, 21, 22 и 23) из контрольных территорий и зон техногенной нагрузки показал, что животные сравнимых демографических групп на контрольных участках в целом, отличаются более крупными размерами, что свидетельствует, прежде всего, о снижении качества и количества кормовых ресурсов на территориях, подверженных влиянию выбросов промышленных предприятий.
Таблица 6 – Межпопуляционная морфологическая изменчивость узкочерепной полевки техногенной и контрольной территорий
|
Возраст |
Зона (кол-во животных) |
Пол |
Масса тела |
Длина тела |
Длина хвоста |
Длина ступни |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Sen (перезимовавшие) |
Т (2) |
самец |
39,98±2,25 |
117,54±2,16 |
28,88±3,12 |
16,13±0,64 |
|
КК (24)* |
35,16±0,96 |
116,61±0,68 |
30,29±0,53 |
16,64±0,18 |
||
|
КБ (13)** |
- |
118,39±1,90 |
28,12±0,99 |
16,42±0,26 |
||
|
Т (2) |
самка |
28,15±0,81 |
99,75±2,75 |
24,05±0,85 |
14,2±0,4 |
|
|
КК (8) |
33,46±0,81 |
116,62±2,11 |
27,36±0,73 |
16,21±0,27 |
||
|
КБ (6) |
- |
120,5±1,59 |
32,08±0,74 |
15,7±0,22 |
||
|
Ad (сеголетки половозрелые) |
Т (12) |
самец |
21,14±1,04 |
95,47±2,45 |
25,36±0,82 |
15,73±0,21 |
|
КК (29) |
24,52±0,62 |
103,04±1,52 |
29,61±0,55 |
16,59±0,13 |
||
|
КБ (19) |
- |
100,68±1,77 |
24,92±0,39 |
15,58±0,17 |
||
|
Т (14) |
самка |
18,73±1,25 |
91,63±2,45 |
25,42±0,72 |
14,52±0,18 |
|
|
КК (54) |
23,94±0,72 |
102,51±1,16 |
27,32±0,41 |
15,49±0,09 |
||
|
КБ (21) |
- |
94,71±1,51 |
23,90±0,54 |
14,95±0,13 |
||
|
Subad (сеголетки не половозрелые) |
Т (27) |
самец |
14,07±0,76 |
83,94±1,65 |
20,69±0,74 |
14,71±0,21 |
|
|
КК (116) |
|
13,34±0,27 |
85,48±0,58 |
23,15±0,24 |
15,49±0,06 |
|
|
КБ (13) |
|
- |
95,59±1,15 |
24,5±0,90 |
15,28±1,16 |
|
|
Т(13) |
самка |
12,15±1,42 |
79,10±3,13 |
25,27±4,15 |
14,64±0,21 |
|
КК (92) |
12,19±0,23 |
83,94±0,65 |
22,36±0,25 |
15,01±0,08 |
||
|
КБ (17) |
- |
91,06±1,27 |
21,72±0,34 |
14,94±0,19 |
||
|
*Данные по контрольной зоне КК взяты из статьи Т. А. Дупал и С. А. Абрамова «Внутрипопуляционная морфологическая изменчивость узкочерепной полевки (Microtus gregalis, Rodentia, Arvicolinae)»; **Данные по контрольной зоне КБ получены из личного сообщения А. В. Макарова Примечания: 1 Т – зона техногенной нагрузки; 2 Контрольная зона: КК – Карасукский участок; КБ – Бийский участок |
||||||
Перезимовавшие самки (Sen) из зон техногенной нагрузки имеют достоверно меньший вес (р˂0,01), чем животные с контрольного Карасукского участка. Однако у перезимовавших самцов в зоне техногенной нагрузки масса тела больше, чем на контрольных территориях. Возможно, эти данные не достоверны, так как из-за недостаточной выборки сделать закономерный вывод не представляется возможным. Половозрелые сеголетки (Ad) имеют меньший вес, достоверно, как у самок (р˂0,001), так и у самцов (р˂0,001) в зонах техногенной нагрузки. Неполовозрелые сеголетки (Subad) по массе значительных различий не имеют (рисунок 20).
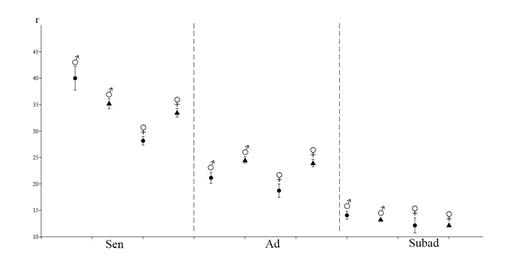
- ⬤ – зона техногенной нагрузки; Контрольная зона: ▲ – Карасукский участок (КК)
Рисунок 20 – Изменчивость массы тела узкочерепных полевок, отловленных на техногенной и контрольной территориях
Длина тела у перезимовавших (Sen) самок узкочерепной полевки из зон техногенной нагрузки достоверно меньше (р˂0,001), чем у полевок с контрольных участков (Карасукского и Бийского). Половозрелые (Ad) и не половозрелые (Subad) сеголетки имеют также достоверно меньшую длину тела, как у самок (р˂0,001), так и у самцов (р˂0,05), чем животные с контрольных участков (рисунок 21).
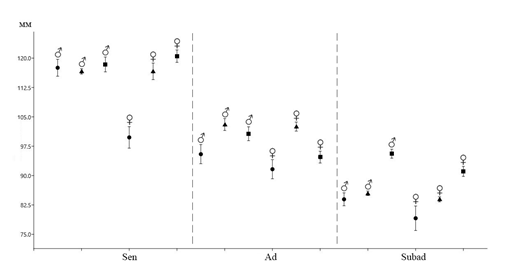
- ⬤ – зона техногенной нагрузки; Контрольная зона: ▲ – Карасукский участок (КК); ■ – Бийский участок (КБ)
Рисунок 21 – Изменчивость длины тела узкочерепных полевок, отловленных на техногенной и контрольной территориях
Перезимовавшие (Sen) самки с контрольных участков (Карасукского и Бийского) имеют достоверно большую длину хвоста (р˂0,001), чем животные из зон техногенной нагрузки. То же самое касается и половозрелых сеголетков (Ad), длина хвоста которых достоверно больше, как у самок (р˂0,001), так и у самцов (р˂0,05), чем у их сородичей с техногенной территории. Эта тенденция характерна и для самцов неполовозрелых (Subad) сеголетков (р˂0,01). В то же время несколько большая длина хвоста у неполовозрелых самок с техногенной территории является недостоверной и вызвана, вероятно, низкой выборкой (рисунок 22).
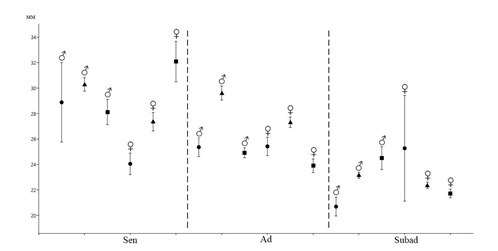
- ⬤ – зона техногенной нагрузки; Контрольная зона: ▲ – Карасукский участок (КК); ■ – Бийский участок (КБ)
Рисунок 22 – Изменчивость длины хвоста узкочерепных полевок, отловленных на техногенной и контрольной территориях
Выявленная тенденция уменьшения размерных показателей длины ступни у животных с зон техногенной нагрузки, по сравнению со зверьками из контрольных территорий, характерна для всех возрастных групп (рисунок 23). Однако, достоверное снижение этих значений характерно лишь для перезимовавших (Sen) самок (р˂0,01), половозрелых (Ad) молодых самок (р˂0,01) и самцов (р˂0,001), а также для неполовозрелых (Subad) молодых самцов (р˂0,001).
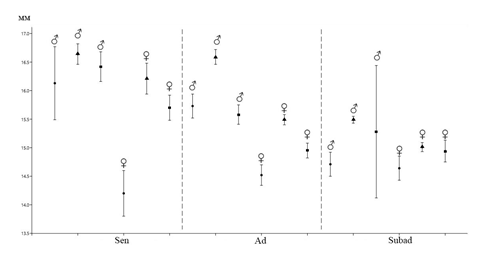
- ⬤ – зона техногенной нагрузки; Контрольная зона: ▲ – Карасукский участок (КК); ■ – Бийский участок (КБ)
Рисунок 23 – Изменчивость длины ступни узкочерепных полевок, отловленных на техногенной и контрольной территориях
Таким образом, проведенный сравнительный анализ морфологических и экстерьерных признаков узкочерепной полевки, показал снижение показателей длины тела, хвоста, ступни, а также массы узкочерепных полевок на техногенных территориях по сравнению с контрольными. Возможно, это является следствием интенсификации обменных процессов, необходимых для нейтрализации и выведения ингредиентов загрязнения, и значительных энергетических затрат, необходимых для выживания полевок [22, с. 485; 77, с. 20–22]. Анализ показывает, что адаптация полевок к неблагоприятному воздействию алюминиевого производства идет по пути интенсификации процессов жизнедеятельности, позволяющих компенсировать повышенную смертность животных в зонах техногенной нагрузки [78, с. 703].