Лабораторная работа № 6 Культивирование. Получение чистых и накопительных свойств. Изучение культуральных свойств и морфологии выделенных культур
Цель работы: ознакомиться с методами получения накопительных и чистых культур мироорганизмов. Освоить технику посева микроорганизмов на плотные и жидкие питательные среды и методики выделения чистых и накопительных культур из различных объектов окружающей среды. Научиться описывать культуральные свойства микроорганизмов.
Оборудование, материалы: спиртовка; бактериологическая петля и препаровальная игла; пробирки со свежеприготовленным скошенным мясопептонным агаром (МПА); чашки Петри с МПА; пробирки со стерильным обезжиренным молоком с добавлением 5 % этилового спирта; сырое молоко; гниющее мясо; бактериальная смесь № 1 (состоящая, например, из чистых культур стафилококка и кишечной палочки) и бактериальная смесь № 2 (состоящая из чистых культур бактерий рода Bacillus и бактерий, не образующих спор); микроскоп; иммерсионное масло; фильтровальная бумага; набор красок для окраски по Граму (фильтровальные бумажки с генцианвиолетом, растворы Люголя и фуксина рабочего); 96 %-ный этиловый спирт: лоток с рельсами для предметных стекол; промывалка;
Краткие теоретические положения. Понятие о чистой и накопительной культуре микроорганизмов
Культивирование – выращивание микроорганизмов на питательных средах. При культивировании на питательных средах вырастают культуры микроорганизмов. Рост культуры – физиологический процесс, в результате которого увеличивается биомасса – масса клеточного вещества данного микроорганизма.
Чистой культурой микроорганизма называют культуру микроорганизмов одного вида, представленную потомством одной клетки. Для выделения чистой культуры используют, как правило, плотные питательные среды, на которых каждая клетка вырастает в виде изолированной колонии – потомства микроорганизмов, образовавшееся из одной клетки.
Выделение чистой культуры микроба является основой бактериологической работы, так как чаще всего исследуемый материал содержит смесь различных видов микробов. Чистые культуры нужны для изучения свойств микроорганизмов и установления их видовой принадлежности. Кроме того, чистые культуры микроорганизмов (дрожжей, микроскопических грибов, молочнокислых, уксуснокислых, пропионовокислых и других бактерий) обладают промышленно ценными свойствами и нужны для получения различных продуктов и веществ, нашедших применение в пищевой промышленности и других отраслях народного хозяйства.
Перед выделением чистой культуры из различных объектов окружающей среды (пищевого продукта, с поверхности плодов и овощей, из почвы, воды и др.), в которых находится множество микроорганизмов, вначале получают накопительные культуры, проводя культивирование в элективных условиях – условиях, способствующих развитию одной культуры и ограничивающих развитие сопутствующих микроорганизмов. Обеспечить элективные условия для микроорганизмов можно только в том случае, если известны особенности обмена веществ выделяемого микроорганизма. Так как различные микроорганизмы используют различные источники питания, то элективные условия легче всего обеспечить, подбирая определенный состав питательных сред. Можно создать элективные условия, обеспечивая соответствующую температуру, рН, освещение и др.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Для получения накопительных культур используют жидкие накопительные питательные среды, различные методы обработки материала, содержащего смесь микробов, а также учитывают другие особенности выделяемых из объекта микроорганизмов.
Для выделения чистых и накопительных культур из различных объектов в лабораториях используют методы посева и пересева. Посевом называется внесение части исследуемого материала в стерильную питательную среду, пересевом – перенос части, выросшей на питательной среде культуры микроорганизмов на другую свежую питательную среду.
Методы выделения накопительных культур микроорганизмов
К таким методам относятся методы обогащения, метод нагревания исследуемого материала для выделения спорообразующих бактерий, метод выделения подвижных форм бактерий (метод Шукевича) и др.
Методы обогащения
Их часто применяют для выделения чистых культур микроорганизмов (например, бактерий группы кишечной палочки (БГКП), сальмонелл и др.) из материалов, в которых мало выделяемых микроорганизмов, но содержится большое количество сопутствующей микрофлоры. Для увеличения численности выделяемого вида микроорганизмов вначале делают посев исследуемого материала в накопительные питательные среды, которые содержат вещества, стимулирующие его рост и угнетающие или задерживающие размножение сопутствующей микрофлоры. Например, для выделения сальмонелл проводят посев в среды обогащения Кауфмана, Мюллера и др., для выделения БГКП – на среду Кесслера. При выделении культур молочнокислых бактерий из почвы, сырого молока или растений посевы делают на стерильное обезжиренное молоко, содержащее 5 %-ного этилового спирта для подавления роста гнилостных бактерий.
Метод нагревания
Применяют для выделения чистых культур споровых форм бактерий (бацилл, клостридий). В этом случае перед посевом исследуемый материал прогревают на водяной бане при температуре плюс 75–85 0С в течение 20–30 мин. Вегетативные формы погибают во время прогревания, а споры микробов остаются живыми и при последующих высевах на плотную среду прорастают, формируя колонии.
Метод выделения подвижных форм бактерий (метод Шукевича).
Заключается в посеве исследуемого материала в конденсационную воду скошенного мясопептонного агара. При размножении подвижные формы микроорганизмов из конденсационной воды распространяются на агаре, как бы вползая на его поверхность.
Методы выделения анаэробных микроорганизмов
Основаны на выращивании микроорганизмов в средах с низкой концентрацией кислорода или в безкислородной среде, что достигается:
- посевом исследуемого материала в среды, содержащие редуцирующие и легко окисляемые вещества (антиоксиданты). В качестве таких веществ чаще всего используют тиогликолят натрия, солянокислый цистеин, кусочки животных и растительных тканей;
- посевом исследуемого материала в глубину плотных питательных сред. Посев делается уколом препаровальной иглой в пробирку со столбиком плотной среды или в расплавленную плотную или полужидкую питательную среду с последующим перемешиванием;
- механическим удалением воздуха из сосудов при выращивании анаэробных микроорганизмов (создают вакуум);
- культивированием анаэробных микроорганизмов в жидких средах под слоем масла;
- культивированием анаэробных микроорганизмов в атмосфере инертного газа, диоксида углерода, азота.
Методы выделения чистых культур микроорганизмов Метод Пастера (метод предельных разведений)
Заключается в том, что из исследуемого материала делают ряд последовательных разведений в жидкой питательной среде. Для этого каплю посевного материала вносят в пробирку со стерильной жидкой средой, из нее каплю переносят в следующую пробирку и так засевают до 8–10 пробирок. С каждым разведением количество микробных клеток, попадающих в среду, будет уменьшаться и можно получить такое разведение, в котором во всей пробирке со средой будет находиться только одна микробная клетка, из которой разовьется чистая культура микроорганизма. Так как в жидких средах микробы растут диффузно, т. е. легко распределяются во всей среде, то изолировать одну микробную клетку от другой трудно. Таким образом, метод Пастера не всегда обеспечивает получение чистой культуры. Поэтому в настоящее время этот метод используется, главным образом, для предварительного уменьшения концентрации микроорганизмов в материале перед посевом его в плотную среду для получения изолированных колоний.
Методы механического разделения микроорганизмов с использованием плотных питательных сред
К таким методам относятся метод Коха и метод Дригальского.
Метод Коха (метод глубинного посева)
Исследуемый материал вносят бактериологической петлей или пастеровской пипеткой в пробирку с расплавленной плотной питательной средой. Равномерно размешивают содержимое пробирки, вращая ее между ладонями. Каплю разведенного материала переносят во вторую пробирку, из второй – в третью и т.д. Содержимое каждой пробирки, начиная с первой, выливают в стерильные чашки Петри. После застывания среды в чашках, их помещают в термостат для культивирования.
Для выделения анаэробных микроорганизмов по методу Коха необходимо ограничить доступ кислорода к культуре. С этой целью поверхность глубинного посева в чашке Петри заливают стерильной смесью парафина и вазелина (1:1). Можно также оставлять посевной материал, тщательно перемешанный с агаризованной средой, непосредственно в пробирке. Ватную пробку при этом заменяют резиновой или заливают поверхность агара смесью парафина и вазелинового масла. Чтобы извлечь выросшие колонии анаэробных микроорганизмов, пробирки слегка нагревают, быстро вращая над пламенем горелки. Агар, прилегающий к стенкам, расплавляется, и столбик легко выскальзывает в подготовленную чашку Петри. Далее столбик с агаром разрезают стерильным скальпелем, колонии извлекают стерильной петлей или стерильной капиллярной рубкой и переносят в жидкую среду.
Метод Дригальского основан на механическом разделении микробных клеток на поверхности плотной питательной среды в чашках Петри. Каждая микробная клетка, фиксируясь в определенном месте, начинает размножаться, образуя колонию.
Для посева по методу Дригальского используют несколько чашек Петри, залитых плотной питательной средой. На поверхность среды вносят каплю исследуемого материала. Затем с помощью стерильного шпателя эту каплю распределяют по всей питательной среде (посев газоном).

Посев также можно проводить штрихом, используя бактериологическую петлю. Этим же шпателем или петлей осуществляют посев во вторую, третью и т.д. чашки. Как правило, в первой чашке после культивирования посева появляется рост микробов в виде сплошного налета, в последующих чашках содержание микроорганизмов снижается и образуются изолированные колонии, из которых отсевом можно легко выделить чистую культуру.
Таким образом, в первых секторах получается сплошной рост, а вдоль последующих штрихов вырастут обособленные колонии, представляющие собой потомство одной клетки.
В целях экономии сред и посуды можно пользоваться одной чашкой, разделив ее на сектора, и последовательно засевать их штрихом (метод истощающего штриха). Для этого материал берут петлей и проводят ею ряд параллельных штрихов сначала по поверхности первого сектора, а затем последовательно оставшимися на петле клетками засевают все другие сектора. При каждом последующем штрихе происходит уменьшение количества засеваемых клеток.
Метод выделения чистых культур с помощью химических веществ используется при изолировании культур микроорганизмов, устойчивых к определенным химическим веществам. Например, с помощью этого метода можно выделить чистую культуру туберкулезных микобактерий, устойчивых к действию кислот, щелочей и спирта. В этом случае исследуемый материал перед посевом заливают 15 % раствором кислоты или антиформином и выдерживают в термостате в течение 3-4 часов. После воздействия кислоты или щелочи клетки туберкулезной палочки остаются живыми, а все другие микроорганизмы, содержащиеся в исследуемом материале, погибают. После нейтрализации кислоты или щелочи обработанный материал высевают на плотную среду и получают изолированные колонии возбудителя туберкулеза.
Биологические методы выделения чистых культур патогенных микроорганизмов основаны на заражении исследуемым материалом лабораторных животных, восприимчивых к данному виду возбудителя. Если патогенный микроорганизм содержится в исследуемом объекте, то лабораторное животное заболевает и погибает. После вскрытия павшего животного из внутренних органов делают посевы на специальные среды, на которых вырастают чистые культуры выделяемых микробов.
Порядок выполнения работы
На первом занятии студенты знакомятся с методами выделения чистых и накопительных культур микроорганизмов. Осваивают технику посева исследуемого материала в чашку Петри, в пробирки со скошенным агаром и с жидкой питательной средой.
При выполнении работы необходимо:
- Для выделения изолированных колоний из бактериальной смеси № 1 сделать посев штрихом в чашку Петри с мясопептонным агаром по методу штриха. Далее чашки помещают в термостат с температурой 37 0С для культивирования в течение 1–2 суток.
- Для выделения спорообразующих бактерий бактериальную смесь № 2 нагреть на водяной бане до плюс 75–85 0С и выдержать в течение 20–30 мин. Далее смесь охладить и сделать посев штрихом бактериологической петлей на поверхность скошенного мясопептонного агара в пробирку. Посев культивируют в течение 1–2 суток при плюс 37 0С.
- Для выделения подвижных форм бактерий из гниющего мяса по методу Шукевича маленький кусочек мяса стерильной петлей или иглой осторожно (по стенке, где нет питательной среды) вносят в конденсат свежеприготовленного скошенного мясопептонного агара. Пробирки термостатируют при плюс 37 0С в течение 1–2 суток.
- Для выделения молочнокислых бактерий из сырого молока 0,5 мл молока вносят стерильной пипеткой в пробирку со стерильным обезжиренным молоком с добавлением 5 % этилового спирта. Далее пробирки помещают в термостат с температурой плюс 30 0С и проводят культивирование в течение суток.
Техника посева и пересева микроорганизмов на питательные среды
Посевы и пересевы микроорганизмов на питательные среды проводят около пламени горелки (но не в пламени), по возможности быстро, чтобы не загрязнить культуры посторонними микроорганизмами. Нельзя делать резких движений, ходить, кашлять и т.п. около работающего с чистой культурой, так как движение воздуха увеличивает опасность случайного заражения культуры и среды. Поэтому посевы и пересевы микроорганизмов следует проводить в боксе.
1. Посев на плотные среды в чашки Петри
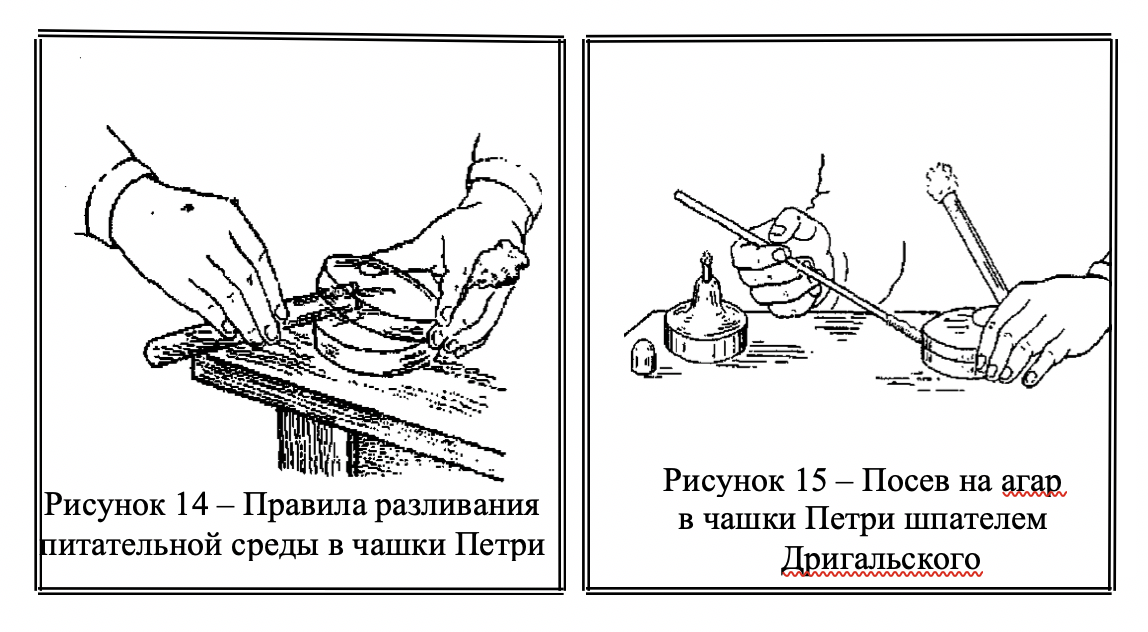
Посев в чашки Петри производят следующим образом: плотную питательную среду в пробирках или колбах расплавляют на кипящей водяной бане, охлаждают до 48–50 0С и, соблюдая правила асептики, разливают ровным слоем толщиной 3–5 мм в стерильные чашки. Посев делают стеклянным шпателем Дригальского или петлей в виде параллельных или зигзагообразных (метод истощающего посева) штрихов.
2. Посев в жидкую питательную среду
Посев в жидкую среду можно производить бактериологической петлей или пипеткой вблизи пламени горелки. Обе пробирки держат в слегка наклонном положении, чтобы не замочить ватно-марлевые пробки. Петлю с микробным материалом опускают непосредственно в стерильную среду и ополаскивают. При внесении клеток, взятых петлей из плотной среды, материал тщательно растирают по стенке пробирки у верхнего края жидкой среды, все время смывая его средой.
3. Пересев на плотные питательные среды в пробирках. Техника посева по этапам показана на рисунке 16.
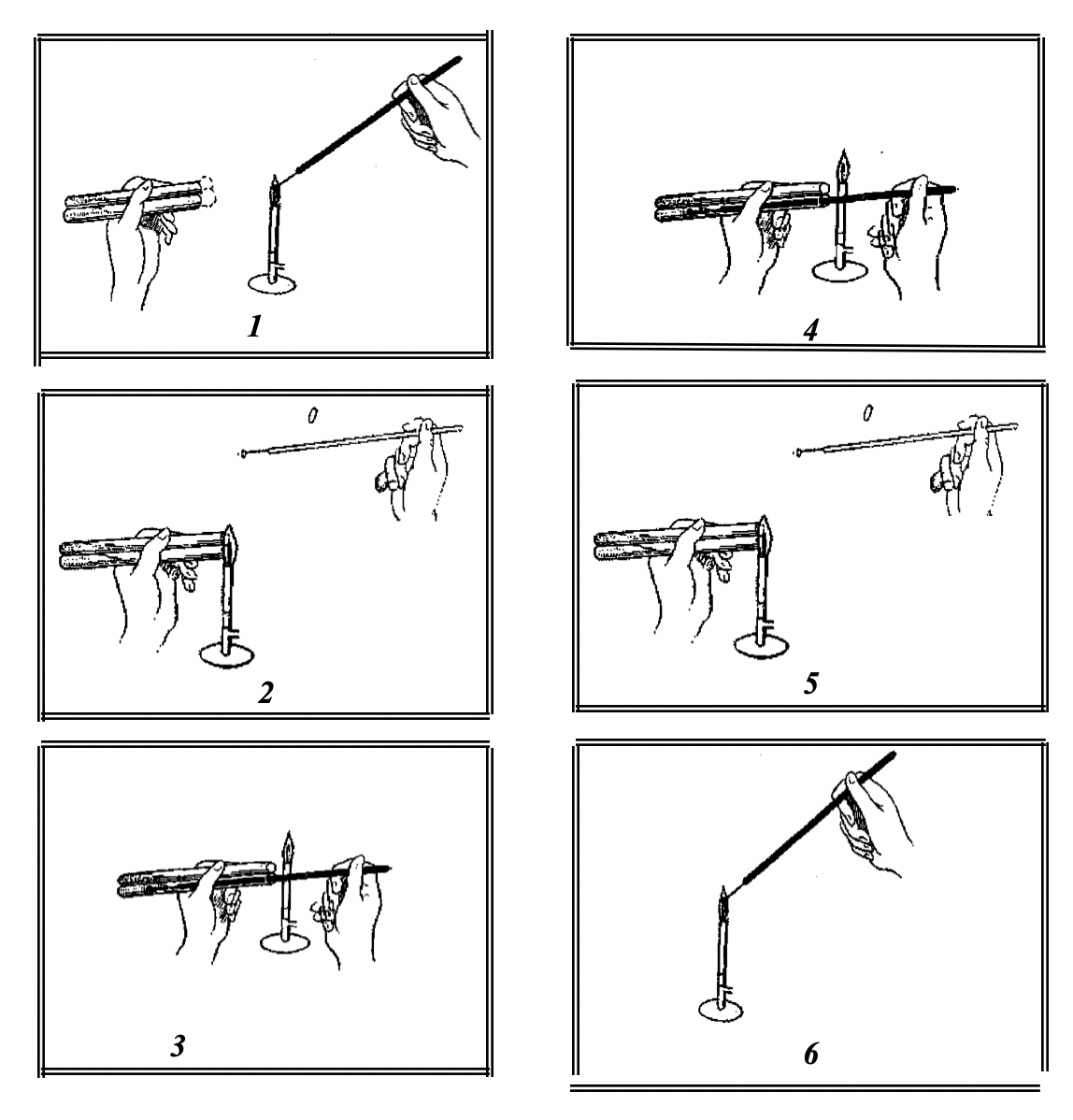
Рисунок 16 – Пересев культуры микроорганизмов в пробирки
Пробирки с культурой и питательной средой помещают на два пальца левой руки в наклонном положении. В правой руке большим и указательным пальцем держат бактериальную петлю и стерилизуют в пламени горелки;
1. Вынимают ватные пробки из обеих пробирок, прижимают их к ладони мизинцем и безымянным пальцами правой руки и обжигают края пробирок. Следят за тем, чтобы пробки не касались посторонних предметов;
2. Петлю вводят в пробирку с пересеваемой микробной культурой. Осторожно, не касаясь стенок, отбирают каплю жидкой культуры. Если производят пересев с косого слоя агара, то для охлаждения петли вначале следует прикоснуться к поверхности агара, где нет культуры, после чего берут небольшое количество микробной массы со скошенной питательной среды;
3. Вводят петлю с материалом в пробирку со стерильной жидкой средой, стараясь не задевать стенок пробирки. При посеве на скошенные питательные среды петлю с клетками микроорганизмов опускают почти до дна, где скапливается небольшое количество конденсационной воды. Слегка касаясь петлей поверхности плотной среды, но не разрыхляя ее, проводят от дна вверх штрих;
4. Петлю вынимают, обжигают края пробирок и внутренние концы пробок, после чего пробирки закрывают;
5. Петлю вновь прокаливают в пламени горелки.
На втором занятии студенты исследуют:
- посев бактериальной смеси №1 в чашке Петри
Посевы, сделанные методом истощающего штриха, рассматривают, выделяют изолированные колонии, отличающиеся по внешнему виду, описывают культуральные свойства выделенных чистых культур микроорганизмов, готовят из описанных колоний фиксированные мазки и окрашивают их по методу рамму. Далее зарисовывают микроскопическую картину и делают вывод о качественном составе микрофлоры бактериальной смеси.
- посев штрихом культуры спорообразующих бактерий, полученной методом нагревания их бактериальной смеси №2 исследуют, приготовив фиксированный мазок, окрасив его по методу рамму и проведя микроскопирование для того, чтобы убедиться, что накопительная культура спорообразующих бактерий выделена. Зарисовывают микроскопическую картину.
- посев гниющего мяса в конденсационную воду скошенного мясопептонного агара внимательно рассматривают, бактериальной петлей отбирают с верхней части поверхности скошенного агара мазеобразный налет, готовят фиксированный препарат, окрашивают его по Граму, зарисовывают микроскопическую картину. При обнаружении в мазках грамотрицательных не образующих спор палочек делают вывод о наличии в исследуемом материале подвижных форм гнилостных бактерий.
- посев сырого молока на накопительную среду в пробирку для выделения молочнокислых бактерий рассматривают и описывают характерные особенности образовавшегося сгустка. Далее готовят фиксированный препарат, окрашивают его краской Муромцева. При микроскопии обращают внимание на внешние признаки выросших на стерильном молоке с 5 %-ного спирта молочнокислых бактерий. Зарисовывают микроскопическую картину.
Изучение культуральных свойств выросших в чашках колоний
Рассматривая выросшие колонии в проходящем свете невооруженным глазом (макроскопически) и с помощью лупы описывают следующее:
1. Форму колоний
Формы колоний, которые могут вырастать на плотной среде в чашках Петри, изображены на рисунке 17.
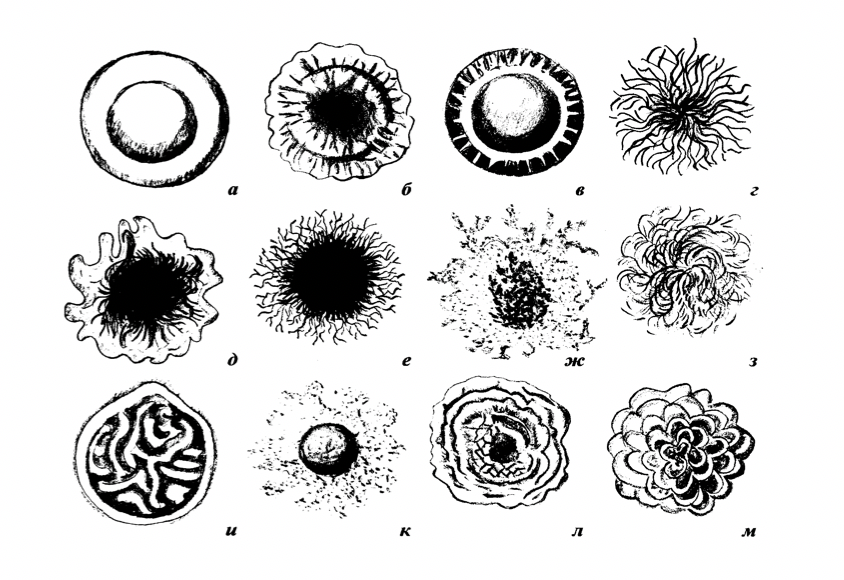
Рисунок 17 – Форма колоний: а – круглая; б – круглая с фестончатым краем; в – круглая с валиком по краю; г; д – ризоидная; е – с ризоидным краем; ж –амебовидная; з – нитевидная; и – складчатая; к – неправильная; л – концентрическая; м – сложная
2. Размеры колоний
Колонии, имеющие диаметр более 4 мм являются крупными, от 2 до 4 мм – средними, от 1 до 2 мм – мелкими, менее 1 мм – точечными или росинчатыми.
3. Цвет колоний
Микроорганизмы, содержащие пигменты могут быть желтого, оранжевого, розового, кремового и др. цветов. Большинство микроорганизмов не содержат пигментов и растут на плотных средах в виде серовато-матовых колоний. Такие колонии называют бесцветными.
4. Рельеф (профиль) колоний
Рельеф или профиль колоний может быть плоским, выпуклым, куполообразным, смешанным - плоским с выпуклым центром, кратерообразным и др. (рисунок 18).
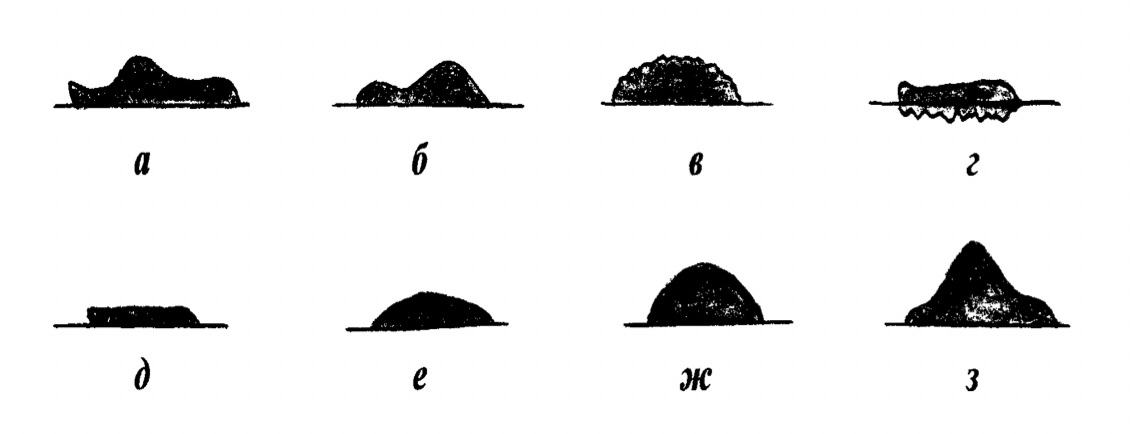
Рисунок 18 – Профиль колоний: а – изогнутый; б – кратерообразный; в – бугристый; г – врастающий в агар; д – плоский; е –выпуклый;ж – каплевидный; з - конусовидный
5. Поверхность колоний
Поверхность колоний может быть гладкой, блестящей, шероховатой, морщинистой, извилистой и т.д.
6. Характер края колоний
Разновидности края колоний изображены на рисунке 19.
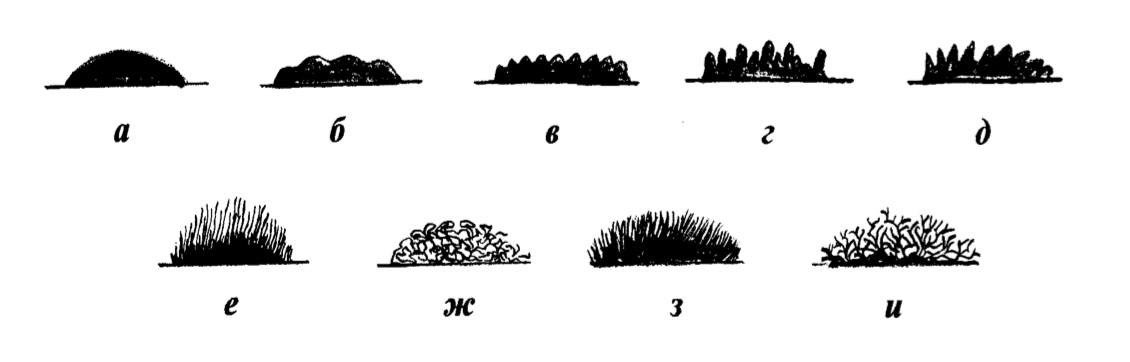
Рисунок 19 – Край колоний: а - гладкий; б – волнистый; в – зубчатый; г – лопастный; д – неправильный; е – реснитчатый; ж – нитчатый; з – ворсинчатый; и - ветвистый
Край может быть ровным (гладким); волнистым; локонообразным (нитчатым); лопастным; бахромчатым; зазубренным; корневидным (ветвистым) и др.
7. Прозрачность колоний
Колонии бывают прозрачные, полупрозрачные и непрозрачные.
8. Структуру колоний
Структура колоний бывает однородная (гомогенная) и неоднородная (гетерогенная). Неоднородные колонии могут быть мелко- и крупнозернистыми, радиально или концентрически исчерченными, чешуйчатыми и др.
9. Консистенцию колоний
Определяется при приготовлении препаратов для микроскопического анализа.
Изучение морфологических свойств микроорганизмов
Готовят фиксированные препараты бактерий по методике, изложенной выше, и окрашивают их по методу Грама. Рассматривают препараты с объективом х90 при максимальном освещении. При изучении морфологических признаков молочнокислых бактерий фиксированный мазок из кисломолочного сгустка окрашивают краской Муромцева.
Оформление и анализ результатов исследований
В отчете студенты кратко конспектируют теоретический материал. Описывают культуральные свойства выросших в чашках Петри колоний. Зарисовывают микроскопические картины выделенных из различных объектов чистых и накопительных культур с учетом морфологических особенностей каждого микроорганизма. Под каждым рисунком подписывают увеличение препарата. Делают соответствующие выводы.
Контрольные вопросы
1. Что такое «чистые культуры» микроорганизмов и для чего их выделяют из объектов окружающей среды?
2. Каким образом создаются элективные условия при выделении накопительных культур микроорганизмов?
3. Какие микроорганизмы можно выделить методом нагревания?
4. Как можно выделить нак5опительные культуры подвижных форм бактерий?
5. Каким образом можно выделить накопительную культуру анаэробных бактерий?
6. Охарактеризуйте методы выделения чистых культур микроорганизмов, основанные на их механическом разделении.
7. Как можно выделить чистую культуру туберкулезной палочки?
8. В чем заключается сущность биологических методов выделения чистых культур патогенных микроорганизмов?
9. По каким признакам описывают культуральные свойства микроорганизмов, выросших на плотных средах в чашках Петри?
10. Перечислите основные этапы пересева микроорганизмов из пробирки в пробирку.