Лабораторная работа № 2 Устройство микроскопа и правила работы с ним. Виды микроскопии. Приготовление фиксированных препаратов бактерий и окраска их простыми методами
Цель работы: изучить устройство светового биологического микроскопа и освоить правила работы с ним. Ознакомиться с различными видами микроскопии. Приобрести навыки по приготовлению фиксированных препаратов бактерий и освоить технику окраски препаратов бактерий простыми методами.
Оборудование, материалы: микроскоп; бактериологические петли; предметные стекла; спиртовка; иммерсионное масло; фильтровальная бумага; краска Муромцева; фуксин; лоток с рельсами; промывалка; кефир; чистые культуры бактерий: Staphylococcus albus, Sarsina flava; 96 %-ный этиловый спирт.
Краткие теоретические положения. Устройство микроскопа и правила работы с ни
Микроскоп (от греч. micros – малый и scopio – смотрю) – прибор, позволяющий получать увеличенное изображение объектов и структур, недоступных глазу человека.
Световые микроскопы могут увеличивать объект (размер объекта 0,5 мкм и больше, с разрешением отдельных структур объекта до 0,1 мкм) более чем в 1500 раз, а электронные микроскопы – более чем в 20 000 раз. Световая микроскопия основывается на законах геометрической оптики и волновой теории образования изображения.
Состоит из трех основных частей: механической, оптической и осветительной.
Устройство микроскопа
Схема светового биологического микроскопа представлена на рисунке 2.
Механическая часть или штатив состоит из ножки, основания, тубусодержателя, предметного столика, монокулярной насадки (тубуса), револьверного устройства, рукоятки грубой фокусировки (макрометрического винта), рукоятки тонкой фокусировки (микрометрического винта).
Тубус – зрительная труба микроскопа. В верхнее отверстие тубуса свободно вставляется окуляр, на нижнем конце тубуса находится вращающееся вокруг своей оси револьверное устройство (револьвер), в которое ввинчиваются объективы. Вращая револьвер, можно быстро сменить объективы во время работы с микроскопом, подводя любой объектив под тубус. Объектив должен быть центрирован. Для этого револьвер поворачивают вокруг своей оси до появления щелчка.
Предметный столик служит для размещения на нем изучаемого препарата. Препарат закрепляют на столике зажимами (клеммами). В центре предметного столика находится отверстие для прохождения лучей света и освещения препарата. В некоторых конструкциях микроскопа предметный столик может передвигаться с помощью винтов, расположенных по периферии предметного столика. Это дает возможность рассмотреть препарат в различных полях зрения.
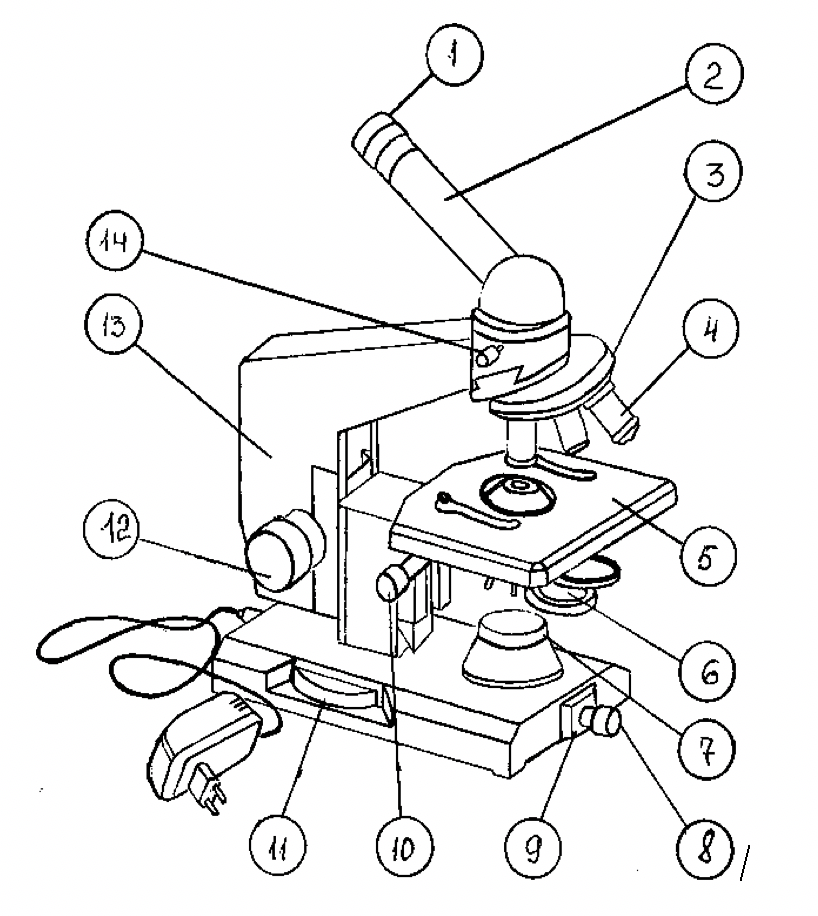
Рисунок 2 – Схема устройства светового биологического микроскопа: 1 – окуляр; 2 – монокулярная насадка (тубус); 3 – револьверное устройство; 4 – объектив; 5 – предметный столик; 6 – конденсор; 7 – корпус коллекторной линзы; 8 – патрон с лампой; 9 – шарнир; 10 – рукоятка перемещения кронштейна конденсора; 11– рукоятка тонкой фокусировки (микрометрический винт); 12 – рукоятка грубой фокусировки (макрометрический винт); 13 – тубусодержатель;14 – винт для крепления насадки
Рукоятки грубой и тонкой фокусировки (макро- и микровинты) служат для перемещения тубуса вверх и вниз, что позволяет установить его на необходимом расстоянии от препарата. При вращении винтов по часовой стрелке тубус опускается, а при вращении против часовой стрелки – поднимается. При вращении макрометрического винта объектив ориентировочно устанавливается на фокус, т.е. на то расстояние от препарата, при котором он делается видимым. Оборот макровинта позволяет переместить тубус на 20 мм. Микрометрический винт служит для точной установки на фокус. Полный оборот его перемещает тубус на 0,1 мм. С микровинтом следует обращаться очень осторожно: допустимо вращение микровинта не более чем на 180 0 в ту или иную сторону.
Оптическая часть является наиболее ценной частью микроскопа. Она состоит из объективов и окуляра.
Окуляр (от лат. oculus – глаз) состоит их двух плосковыпуклых линз, заключенных в общую металлическую оправу. Верхняя линза – глазная (увеличивающая), нижняя – собирающая. У окуляров с большим увеличением фокус короче, поэтому меньше и длина окуляра. Между линзами имеется диафрагма, ограничивающая поле зрения и задерживающая краевые лучи света. Микроскопы снабжены тремя сменными окулярами, увеличение которых указано на корпусе окуляра (х7; х10; х15).
Объективы ввинчиваются в гнезда револьверного устройства и состоят из системы линз, заключенных в металлическую оправу. Передняя (фронтальная) линза объектива является самой маленькой и единственной, дающей увеличение. Остальные линзы в объективе только исправляют недостатки полученного изображения (явления сферической и хроматической аберрации) и называются коррекционными.
В гнезда револьверного устройства ввинчиваются четыре объектива, увеличение которых указано на корпусе объектива (х8; х20; х40; х90 или 100). Каждый объектив характеризуется своим фокусным расстоянием (расстоянием между предметным стеклом и фронтальной линзой): объектив х8 имеет фокусное расстояние около 9 мм, объектив х40 – 0,65 мм, объектив х90 – 0,15 мм.
Объективы подразделяются на сухие и иммерсионные.
При работе с сухими объективами (х8, х20, х40) между фронтальной линзой и препаратом находится воздух. В этом случае лучи света проходят среды с различными показателями преломления (покровное стекло, воздух), часть их отклоняется и не попадает в объектив.
При работе с иммерсионными объективами (х90 или х100) для устранения светорассеяния расстояние между фронтальной линзой объектива и препаратом заполняют иммерсионным (кедровым) маслом, показатель преломления лучей света которого близок к показателю преломления лучей света, проходящего через стекло.
Общее увеличение микроскопа определяется как произведение увеличения объектива на увеличение окуляра. Например, если в работе используют окуляр х15, а под тубусом находится объектив х90, то увеличение рассматриваемого с помощью микроскопа объекта составит х1350.
Осветительная часть микроскопа состоит из двухлинзового конденсора, ирис-диафрагмы и патрона с низковольтной лампочкой накаливания, питающейся через понижающий трансформатор от сети напряжения 120–220 В.
Конденсор служит для лучшего освещения препарата. Он собирает световые лучи в пучок и направляет их через отверстие предметного столика на препарат. С помощью рукоятки для перемещения кронштейна конденсора его можно перемещать вверх и вниз, благодаря чему меняется угол сходимости лучей и, следовательно, степень освещения объекта. Чем выше положение конденсора, тем лучше освещен препарат.
Ирис-диафрагма располагается под конденсором и служит для регулировки потока света, поступающего в конденсор. Она состоит из металлических серповидных пластинок. Расширить или сузить отверстие диафрагмы можно с помощью специального рычажка. При вращении его по часовой стрелке отверстие ирис-диафрагмы увеличивается и, следовательно, увеличивается степень освещения объекта.
При работе с иммерсионными объективами степень освещения препарата должна быть максимальной, поэтому шторку ирис-диафрагмы открывают, а конденсор поднимают в крайнее верхнее положение.
При работе с сухими объективами, как правило, рассматривают неокрашенные объекты. Для достижения контрастности конденсор опускают вниз, а отверстие ирис-диафрагмы уменьшают.
Правила работы с микроскопом
1. На рабочем столе микроскоп ставят тубусодержателем к себе на расстоянии 3–5 см от края стола;
2. Включают микроскоп в сеть и устанавливают правильное освещение;
3. На предметный столик помещают исследуемый препарат и закрепляют его клеммами;
4. Под тубус помещают нужный объектив и с помощью макро и микровинтов устанавливают фокусное расстояние. Так, при работе с иммерсионными объективами на препарат предварительно наносят каплю иммерсионного масла и осторожно опускают тубусодержатель макровинтом до соприкосновения со стеклом. Затем, внимательно смотря в окуляр, очень медленно поднимают тубусодержатель, вращая его против часовой стрелки, до тех пор, пока не увидят изображение. Точную наводку объектива на фокус производят микрометрическим винтом. При работе с сухими объективами препарат вначале рассматривают с объективом х8. Поднимая с помощью макровинта тубусодержатель и внимательно смотря в окуляр, устанавливают фокусное расстояние (около 9 мм) и добиваются четкости изображения, используя микрометрический винт. Затем, вращая револьверное устройство вокруг своей оси, под тубус помещают объектив на х20 или х40. При этом под тубус не должен попасть объектив х90. В револьверном устройстве объективы располагаются таким образом, что если найдено изображение с объективом х8, то при рассмотрении препарата с объективами большего увеличения нужно слегка подрегулировать четкость изображения с помощью макро- и микрометрических винтов;
5. Во время микроскопирования необходимо держать оба глаза открытыми и пользоваться ими попеременно;
6. После окончания работы следует убрать препарат с предметного столика, опустить вниз конденсор, поставить под тубус объектив х8, удалить мягкой тканью или марлей, смоченной в спирте, иммерсионное масло с фронтальной линзы объектива х90, под объектив положить марлевую салфетку, опустить тубусодержатель.
Виды микроскопии
Основными характеристиками микроскопа являютсяобщее увеличение и разрешающая способность.
Общее увеличение не характеризует качества изображения, которое может быть четким и нечетким.
Четкость получаемого изображения определяется разрешающей способностью микроскопа, т.е. той наименьшей величиной объектов или их деталей, которые можно увидеть с помощью этого прибора. Разрешающая способность зависит от длины проходящего через объект света, показателя преломления оптической среды (показатель преломления воздуха равен 1,0; иммерсионного масла – 1,516; стекла – 1,520) и апертурного угла объектива. Эту зависимость вывел немецкий физик Эрнст Аббе во второй половине XIX века:
d = l / 2 n sin a,
где: d – минимальное расстояние между двумя точками, видимыми раздельно;
l - длина волны света, проходящего через исследуемый объект;
n sina - числовая апертура, где n –показатель преломления светом оптической среды, a - апертурный угол объектива.
На рисунке 3 представлена схема, иллюстрирующая понятие апертурного угла микроскопа (стрелками обозначен ход световых лучей).

Рисунок 3 – Схема, иллюстрирующая понятие апертурного угла: g – отверстный угол; a – апертурный угол; 1 – фронтальная линза объектива; 2 – пространство между объектом и объективом; 3 – предметное стекло с объектом; 4 – конденсор; 5 – диафрагма; рр1 –главная оптическая ось
Э. Аббе доказал, что нет смысла беспредельно повышать увеличение светового микроскопа. Минимальное расстояние между двумя точками при освещении объекта светом с длиной волны 550 нм, к которому наиболее чувствителен глаз, при использовании микроскопа, апертурный угол которого 900 (это предельный угол для которого sina=1), для сухой системы составляет около 300 нм, а для иммерсионной системы – около 200 нм.
Таким образом, повысить разрешающую способность микроскопа можно путем:
- снижения длины волны света, проходящего через объект;
- использования иммерсионной системы;
- повышения апертурного угла до предельного (до 900).
Микроскопия в темном поле
Используется для исследования слишком малых и слабоконтрастных живых объектов. При микроскопии этим методом используют специальный конденсор темного поля, центр которого затемнен. Поэтому центральный пучок световых лучей не попадает в объектив и поле зрения микроскопа остается темным. Объект освещается только лучами, попадающими на него под углом. Рассеиваясь на объекте, часть лучей изменяет направление и попадает на объектив. Объект становится видимым как светящаяся точка на темном фоне. Метод темного поля позволяет получить представление о внешней форме живых неокрашенных объектов и их движении.
Микроскопия в темном поле позволяет увеличить разрешающую способность объектива примерно в 10 раз и рассматривать объекты, размеры которых находятся за пределами обычного микроскопа. Повышение разрешающей способности достигается за счет увеличения апертурного угла.
Фазово-контрастная микроскопия
Дает возможность изучать живые объекты без окраски и фиксирования. Глаз человека реагирует на изменения амплитуды световой волны (интенсивность, контрастность) и ее длины (цвет), но не воспринимает различий по фазе. В биологических препаратах чередуются места, которые в разной степени поглощают свет. Проходя через них, световые волны изменяют свою амплитуду. Такие участки объекта называют амплитудными, и под микроскопом они выглядят более темными. Структурные элементы объектов пропускают лучи одинаковой длины и амплитуды, но смещают их фазу. Величина смещения зависит от толщины и показателя преломления структур, но видимых изменений практически не дает. Такие препараты являются неконтрастными.
С помощью фазово-контрастного устройства фазовые изменения световых волн, проходящих через прозрачные объекты, превращаются в амплитудные, благодаря чему детали рассматриваемых объектов становятся видимыми и контрастными.
Фазово-контрастное устройство дает возможность изучать структуры клеток: жгутики и оболочки бактерий, ядра и митохондрии дрожжей и грибов.
Таким образом, хотя разрешающая способность при использовании фазово-контрастной микроскопии не меняется при сравнении со светопольной, качество изображения улучшается за счет повышения контрастности.
Люминесцентная микроскопия
Люминесцентная микроскопия позволяет изучать клетки в живом виде, выявлять мембранные структуры и получать высококонтрастные цветные изображения микроорганизмов.
Сущность явления люминесценции заключается в том, что некоторые молекулы структурных элементов клетки (пигменты, витамины, алкалоиды и др.) способны поглощать часть энергии падающего света определенной длины волны, переходить в электронно-возбужденное состояние и испускать свет с другой длиной волны. Источником возбуждения могут быть ультрафиолетовые лучи (300–400 нм) и видимый свет коротковолновой области спектра (400–460 нм).
Клетки микроорганизмов обладают слабой собственной (первичной) люминесценцией. Ее можно усилить предварительным окрашиванием препаратов нетоксическими красителями – флуорохромами (акридин оранжевый, нейтральный красный, аурамин, флуоресцин и др.). В результате возникает вторичная люминесценция. Для ее возбуждения достаточно использовать сине-фиолетовую часть спектра. В результате возникает высококонтрастное цветное изображение рассматриваемого объекта.
Таким образом, при использовании люминесцентной микроскопии разрешающая способность микроскопа возрастает по сравнению со светопольной микроскопией за счет уменьшения длины волны проходящего через объект света.
Электронная микроскопия
Максимальная разрешающая способность оптических микроскопов составляет около 0,2 мкм и зависит от длины волны используемых лучей света. Увеличить разрешение в 100 и более раз можно, если вместо световых или ультрафиолетовых лучей применять поток движущихся электронов, обладающих волновыми свойствами (длина волны около 0,04 нм).
Поток электронов движется в безвоздушном пространстве от источника электронов (раскаленная нить вольфрамовой пушки) по направлению к флуоресцентному экрану и вызывает равномерное свечение его. Если же на пути электронов поместить какой-либо объект, то в зависимости от его плотности электроны будут больше или меньше задерживаться, а соответствующие места на экране окажутся более или менее затемненными. Этот простой принцип работы современного электронного микроскопа дополнен принципом отклонения электронных лучей в магнитном поле подобно тому, как световые лучи отклоняются увеличивающими стеклянными линзами (электромагнитные линзы).
Высокая разрешающая способность современных электронных микроскопов позволяет наблюдать и изучать объекты, невидимые в оптических микроскопах: вирусы и фаги, микоплазмы, строение клеток прокариотов и эукариотов, их макро- и микроструктурные элементы. Препараты для электронной микроскопии готовят в виде очень тонких срезов на специальных ультрамикротомах или на тончайших пленках – подложках из коллодия. Следовательно, в электронных микроскопах микроорганизмы исследуют не в живом состоянии, а в виде фиксированных препаратов.
Порядок выполнения работы
На занятии студенты знакомятся с устройством микроскопа и правилами работы с ним, видами микроскопии, основными особенностями их устройства и принципами их работы. Затем они осваивают технику отбора чистых культур микроорганизмов и методику приготовления фиксированных препаратов бактерий. Готовят фиксированные препараты из чистых культур (Staphylococcus albus, Sarsina flava) и естественных мест обитания (кефира, зубного налета). Далее окрашивают эти препараты простыми методами (чистые культуры и зубной налет – фуксином, а кефир – краской Муромцева) и рассматривают их с использованием иммерсионной системы с объективом х90 или х100 при максимальном освещении.
Техника отбора чистых культур микроорганизмов
Отбор проб чистых культур бактерий и дрожжей, которые вырастают на поверхности плотной среды в виде мазеобразного налета или в жидкой среде ведут в следующей последовательности:
- Зажигают спиртовку.
- Пробирку с культурой помещают в левую руку между большим и указательным пальцами в наклонном положении. Поверхность с налетом микроорганизмов должна быть обращена вверх и хорошо видна
- Петлю держат вертикально в пламени горелки и прокаливают докрасна, затем наклоняют и обжигают примыкающую к ней часть петледержателя.
- Мизинцем и безымянным пальцем правой руки прижимают к ладони наружную часть ватной пробки, вынимают ее из пробирки и держа в таком положении, не касаясь окружающих предметов.
- Края открытой пробки обжигают в пламени горелки.
- Осторожно вводят стерильную петлю в пробирку с культурой и охлаждают ее о стенки пробирки или прикоснувшись к питательной среде, свободной от микроорганизмов. Немного отстранив пробирку с культурой от пламени горелки, легким движением осторожно отбирают небольшое количество микробной массы с поверхности среды или каплю жидкости с клетками. Вынимая петлю из пробирки, следят за тем, чтобы отобранный материал не касался стенок, и петля не оказалась над пламенем горелки.
- Снова обжигают в пламени горелки край пробирки, затем, легким круговым движением, обжигают ватно-марлевую пробку и закрывают пробирку.
- Пробирку с культурой ставят в штатив, а извлеченный материал используют для приготовления препарата.
- Клетки микроорганизмов, оставшиеся не петле, сжигают в пламени горелки.
Отбор чистых культур микроскопических грибов ведут с использованием препаровальной иглы. Из пробирки отбирают кусочек мицелия, слегка погружая иглу в питательную среду таким образом, чтобы не нарушить структуру мицелия.
Приготовление препаратов фиксированных клеток
Фиксированными считают клетки микроорганизмов, в которых прерваны жизненные процессы, но полностью сохранена тонкая структура.
Для получения фиксированных препаратов важно правильно подготовить предметные стекла. Они должны быть чистыми и тщательно обезжиренными. Для этого стекла, бывшие в употреблении, выдерживают 1–2 часа в хромовой смеси (в 1 л воды вносят 50 г бихромата калия и 100 г технической серной кислоты), после чего ополаскивают теплой водой и спиртом. Можно также кипятить стекла в течение 15 мин. в растворе соды или мыльной воды. Для проверки чистоты стекла на его поверхность наносят каплю воды. При достаточном обезжиривании капля растекается равномерно. Берут стекла пинцетом или аккуратно за грани, так как пальцы оставляют на поверхности жирные пятна.
Приготовление фиксированных препаратов ведут в следующей последовательности:
- На середину чистого обезжиренного предметного стекла стерильной петлей наносят небольшую каплю воды. В нее вносят исследуемый материал, отобранный по методике, описанной в разделе 2.2.1. Полученную суспензию равномерно распределяют по поверхности стекла тонким слоем таким образом, чтобы препарат распределился на площади примерно 2–3 см2.
- Полученный мазок высушивают при комнатной температуре на воздухе.
- Производят фиксацию мазка. Для этого стекло с высохшим мазком проводят 3-4 раза над пламенем горелки той стороной, где мазок отсутствует.
Цель:
- умертвить клетки микроорганизмов и сделать их безопасными (что особенно важно при работе с патогенными микроорганизмами);
- зафиксировать (закрепить) мазок на стекле (чтобы они не смывались при окрашивании);
- улучшить окрашивание, поскольку мертвые клетки лучше адсорбируют на своей поверхности различные красители.
Помимо термической обработки, применяют также фиксацию химическими веществами: погружают предметное стекло с мазком в мензурку с 96 %-ным этанолом на 15–20 мин, с ацетоном на 5 мин, со смесью 96 %-ного этанола и 40 %-ного формалина (соотношение 95:5) на 2 мин. и др.
Виды фиксации:
- физический – в пламени спиртовки;
- химический – в растворах спирта, ацетона, смеси Никифорова (1:1 спирт и эфир).
Цели фиксации:
- обеззараживание патогенных микробов;
- закрепление клеток на стекле;
- убитые микроорганизмы лучше воспринимают красители.
Окраска фиксированных препаратов микроорганизмов простыми методами
Фиксированные препараты нельзя рассмотреть под микроскопом, так как они являются бесцветными и пропускают световые лучи. Поэтому их окрашивают, используя простые или сложные методы.
При окрашивании фиксированных мазков простыми методами используют один краситель (фуксин, краска Муромцева, генцианвиолет, метиленовая синь и др.).
Последовательность окрашивания мазка простыми методами следующая:
1. На фиксированный препарат наносят несколько капель красителя таким образом, чтобы он покрывал всю поверхность мазка и выдерживают в течение определенного времени. Так, при окраске фуксином на мазок наносят несколько капель красителя и выдерживают его на мазке 2–3 мин. При окрашивании препарата из кефира на него краску Муромцева наносят на мазок через полоску фильтровальной бумаги на 3-5 мин.
2. Краску смывают с мазка слабой струей до бесцветной смывной воды. При этом стекло держат в наклонном положении над лотком.
3. Мазок подсушивают фильтровальной бумагой, которую осторожно прикладывают к стеклу, и досушивают на воздухе.
4. На окрашенный мазок наносят каплю иммерсионного масла и рассматривают препарат с объективом х90 или х100.
Правила иммерсионной микроскопии
- Микроскоп устанавливают в рабочее положение – увеличение объективов
- Устанавливают освещение, включая лампу или направляя свет на зеркало микроскопа. Конденсор должен быть поднят до упора, диафрагма открыта.
- На препарат наносят каплю иммерсионного масла
- Препарат помещают на предметный столик и фиксируют его клеммами
- Наблюдая сбоку, опускают тубус с объективом 90х, 100х макровинтами в масло почти до соприкосновения с препаратом
- Затем, глядя в окуляр (7х, 10х), макровинтом очень медленно поднимают объектив до появления изображения и с помощью микровинта производят окончательную фокусировку четкого изображения
- При микроскопии определяют взаимное расположение микроорганизмов, их размеры, форму, структуру, окраску
- После просмотра препарата револьвер переводят на малое увеличение 8х и только после этого препарат снимают со столика
- Фронтальную линзу объектива протирают марлей, смоченной чистым бензином или эфиром для удаления остатков иммерсионного масла
- Затем опускают предметный столик (или конденсор в микроскопах с неподвижным столиком) и накрывают микроскоп чехлом.
Оформление и анализ результатов исследований
В отчете студенты должны кратко законспектировать теоретический материал. Наблюдаемые под микроскопом картины нужно зарисовать и сделать заключение о морфологии исследованных чистых культур, а также микрофлоры кефира и зубного налета. Под рисунками необходимо указать увеличение и подписать название изучаемого объекта.
Контрольные вопросы
1. Каково устройство биологического микроскопа?
2. Из каких частей и механизмов состоит механическая часть микроскопа?
3. Назовите основные характеристики микроскопа.
4. Что понимают под разрешающей способностью микроскопа? Как она определяется?
5. Что составляет оптическую систему микроскопа?
6. Объективы бывают сухие и иммерсионные. Что это значит?
7. Как определяется общее увеличение микроскопа?
8. Что входит в состав осветительной системы микроскопа?
9. Как следует настроить осветительную систему при работе с иммерсионным объективом?
10. Какие существуют правила работы с микроскопом?
11. Какие особенности устройства и принципы работы темнопольного, фазово-контрастного, люминесцентного и электронного микроскопов?
12. Чем определяется четкость получаемого изображения?
13. Перечислить основные правила работы с микроскопом.
14. Как проводится отбор проб чистой культуры микроорганизма?
15. Перечислите основные этапы приготовления фиксированного окрашенного препарата.