Лабораторная работа № 3 Изучение морфологии бактерий. Сложные и дифференциальные методы окраски бактерий
Цель работы: ознакомиться с морфологическим разнообразием бактерий и основными признаками, используемыми при их идентификации. Изучить различные сложные и дифференциальные методы окраски бактерий и их структур и разобраться в сущности этих методов и цели их использования. Освоить технику окраски бактерий по Граму и спор бактерий по Шефферу-Фултону.
Оборудование, материалы: микроскоп, бактериологические петли, предметные стекла, спиртовка, иммерсионное масло, фильтровальная бумага; набор красок для окраски по Граму (фильтровальные бумажки с генцианвиолетом, растворы Люголя и фуксина рабочего) и окраски спор по Шефферу-Фултону (растворы бриллиантовой зелени и сафранина); 96 %-ный этиловый спирт: лоток с рельсами для предметных стекол; промывалка; чистые культуры бактерий: Staphylococcus albus; Sarsina flava; Escherichia coli; Bacillus subtilis.
Краткие теоретические положения. Основные признаки, используемые при идентификации микроорганизмов
Определение систематической принадлежности микроорганизмов – сложная задача, требующая длительных наблюдений, значительного количества специфических исследований и биохимических анализов.
При идентификации микроорганизмов учитывают:
- морфолого-цитологические признаки. К ним относятся строение, форма и размеры клеток, их взаимное расположение, тинкториальные свойства (особенности при окрашивании различными красителями), способность к образованию спор и капсул, подвижность, наличие жгутиков, образование в клетках некоторых включений, особенности размножения;
- физиолого-биохимические признаки. При изучении физиолого-биохимических признаков устанавливают отношение микроорганизмов к различным источникам углерода и азота, потребность в кислороде, температурные границы роста, солеустойчивость, чувствительность к антибиотикам, ферментативные тесты;
- культуральные признаки. К таким признакам относятся особенности роста микроорганизмов на плотных и жидких питательных средах.
При идентификации бактерий рекомендуется также учитывать дополнительные признаки: серологические свойства, фагоустойчивость, химический состав клеточных стенок, содержание отдельных нуклеотидов в нуклеоиде (единственной хромосоме бактерий – молекуле ДНК, состоящей из двух спирально закрученных цепочек нуклеотидов, замкнутых в кольцо). Чем больше у различных микроорганизмов общих признаков, тем ближе они находятся друг к другу по степени родства.
Основными признаками, позволяющими распределить микроорганизмы на группы, являются морфологические признаки, которые легко и достаточно быстро можно определить с помощью микроскопа.
Морфологические признаки бактерий
Бактерии объединяют обширную группу в основном одноклеточных микроорганизмов, разнообразную по форме, размерам и обмену веществ. Они являются прокариотными микроорганизмами.
При дифференциации бактерий путем микроскопии учитывают размеры и формы клеток, их взаимное расположение, химический состав и строение клеточных стенок, способность образовывать споры и капсулы, подвижность.
Основными формами бактерий, которые присутствуют в пищевом сырье, а также в продуктах растительного и животного происхождения, являются сферические бактерии (кокки) и палочковидные бактерии (палочки).
К основным морфологическим признакам кокков относятся их размеры (диаметр кокков в среднем составляет 1–2 мкм) и взаимное расположение. Взаимное расположение кокков определяется направлением образования перегородок при делении клеток. Если после деления клетки расходятся и располагаются поодиночке, то такие формы называются монококками или микрококками. Если при делении образуются скопления, напоминающие виноградные грозди, их относят к стафилококкам. Кокки, остающиеся после деления в одной плоскости связанными парами, называются диплококками, а образующие разной длины цепочки – стрептококками. Сочетания из четырех кокков, появляющиеся после деления клетки в двух взаимно перпендикулярных плоскостях представляют собой тетракокки. Если кокки делятся в трех взаимно перпендикулярных плоскостях, то они образуют скопления кубической формы – сарцины. Как выглядят различные скопления кокков под микроскопом изображено на рисунке 4.
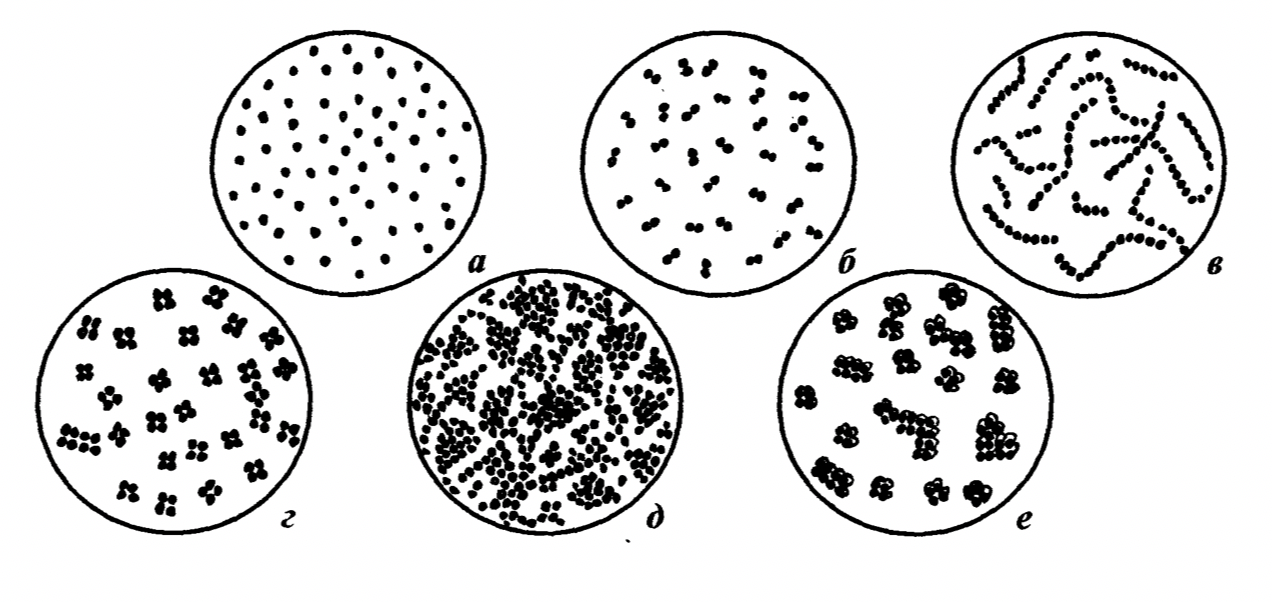
Рисунок 4 – Взаимные расположения кокков: а - микрококки; б - диплококки; в - стрептококки; г - тетракокки; д - стафилококки; е - сарцины
Основными морфологическими признаками палочковидных бактерий, которые определяются путем микроскопии, являются размеры палочек (средняя длина палочек – 2–7 мкм, диаметр в поперечнике – 0,5–1 мкм), взаимное расположение клеток, способность образовывать споры, подвижность.
Палочковидные бактерии могут располагаться поодиночке, попарно(диплобактерии) и цепочками (стрептобактерии).
При микроскопии легко можно определить спорообразующие и не спорообразующие формы палочковидных бактерий. Вегетативные клетки хорошо адсорбируют красители на своей поверхности и полностью окрашиваются. Оболочка споры малопроницаема, краски в них почти не проникают и под микроскопом споры имеют вид округлых или овальных блестящих зерен. Палочки, образующие споры называются бациллами и клостридиями. У бацилл размер споры не превышает ширину клетки и поэтому при образовании споры форма клетки не меняется. У клостридий диаметр споры больше толщины клетки и поэтому при созревании споры клетка приобретает форму веретена (если спора располагается в центре клетки) или барабанной палочки (если спора располагается на одном из полюсов клетки). Морфологические разновидности палочковидных бактерий представлены на рисунке 5.
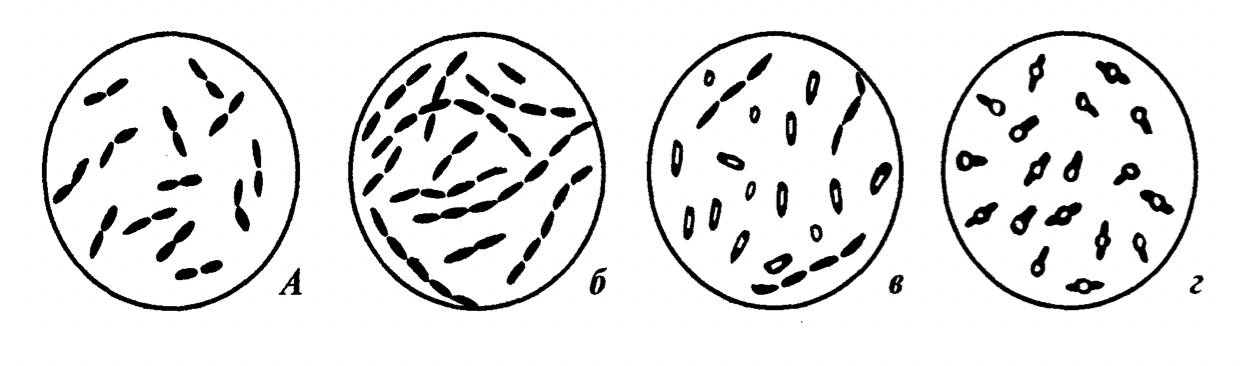
Рисунок 5 – Морфология палочковидных бактерий: а - диплобактерии; б - стрептобактерии; в - бациллы; г - клостридии
При идентификации палочек диагностическое значение имеют также расположение спор в клетках бацилл и клостридий, наличие и расположение жгутиков, способность образовывать капсулы.
Сложные и дифференциальные методы окраски бактерий
Различают простые, сложные и дифференциальные методы окраски бактерий. При простой окраске используют один краситель и прокрашивают всю клетку. Сложное окрашивание предусматривает применение двух или нескольких красителей (например, при определении отношения бактерий к окраске по Граму). Дифференциальное окрашивание основано на индивидуальном отношении биологических структур клетки к различным красителям (окраска спор, оболочки, капсул, метахроматина и др.). При этом так же, как и в сложных методах, как правило, используется несколько красителей.
Сложные методы окраски позволяют распределить бактерии на группы, что имеет важное диагностическое значение при их идентификации. Среди сложных методов наиболее широкое применение нашел метод окраски бактерий по Граму, позволяющий разделить бактерии в зависимости от химического состава и структуры клеточной стенки на две основные группы – грамположительные (грам+; Г+) и грамотрицательные (грам-; Г-). Грамположительные бактерии по этому методу окрашиваются в сине-фиолетовый цвет, а грамотрицательные – в розовый. К сложным методам относится и метод окраски по Цилю-Нильсену, позволяющий дифференцировать бактерии на две группы по кислотоустойчивости. Этот метод позволяет выявить туберкулезную палочку, бактерии паратуберкулезного энтерита крупного рогатого скота и другие кислотоустойчивые микроорганизмы.
При использовании дифференциальных (специальных) методов можно окрасить споры, определить наличие в клетках запасных питательных веществ, выявить клеточные структуры.
При окраске спор, например, можно использовать различные методы (методы Шеффера-Фултона, Пешкова, Златогорова, Меллера и др.), основанные на разрыхлении малопроницаемой для красителей оболочки спор различными способами (путем нагревания, обработки препарата кислотами, щелочами) с одновременным или дальнейшим их окрашиванием концентрированным красителем. После такой обработки препарат промывают водой (при этом клетки обесцвечиваются, а споры остаются окрашенными) и докрашивают вегетативные клетки красителем контрастного цвета.
Большое значение с диагностической точки зрения имеет окрашивание капсул. Капсульные вещества слабо окрашивается и при простом методе окраски выступает в виде бледной каймы бесцветного или слабоокрашенного ореола вокруг микробной клетки. Для того чтобы лучше рассмотреть капсулы, используют методы Михина, Муромцева, Ольта, Бурри-Гинса и др. В этих методах используют один или несколько красителей. Так, для окраски капсул по Бурри-Гинсу, суспензию слизеобразуюших бактерий смешивают на краю предметного стекла с каплей туши и с помощью другого предметного стекла распределяют тонким слоем по поверхности. Далее препарат фиксируют над пламенем горелки и окрашивают фуксином или сафранином. При микроскопии такого препарата на темном фоне отчетливо выделяются окрашенные в красный цвет бактерии, окруженные бесцветными капсулами.
С другими специальными методами, позволяющими определить наличие и содержание запасных веществ в клетках (определение гликогена и волютина), студенты ознакомятся при исследовании качества производственных дрожжей (Лабораторная работа №6).
Порядок выполнения работы
На занятии студенты знакомятся с основными признаками, которые учитываются при идентификации микроорганизмов, обращают внимание на морфологические признаки кокков и палочек, диагностическое значение сложных и дифференциальных методов окраски бактерий. Осваивают технику окраски бактерий по методу Грама. Определяют, какие из представленных для исследования бактерии относятся к грамположительным, а какие к грамотрицательным. Готовят фиксированный мазок из чистой культуры спорообразующих бактерий Bacillus subtilis и окрашивают его по Шефферу-Фултону.
Окраска бактерий по методу Грама
Сущность метода заключается в различии химического состава и строения клеточной стенки грамположительных и грамотрицательных бактерий.
Клеточная стенка грам+ бактерий толстая, но однослойная, содержит много пептидогликана – муреина, а также тейховые кислоты, которые образуют прочное соединение с красителями - генцианвиолетом и йодом и поэтому остаются окрашенными после обработки мазка спиртом. Таким образом, грам+ бактерии по методу Грама окрашиваются в сине-фиолетовый цвет.
У грам- бактерий клеточная стенка тонкая, но двухслойная. Муреина мало, причем он содержится во внутреннем слое клеточной стенки, тейхоевые кислоты отсутствуют. Внешний слой клеточной стенки содержит, главным образом, вещества, обладающие гидрофобными свойствами – липополисахариды и липопротеиды. Эти вещества не образуют прочного комплекса с красками генцианвиолетом и йодом и поэтому клетки обесцвечиваются после обработки 96 %-ным этиловым спиртом и после дополнительной окраски красителем фуксином окрашиваются в бледно-розовый цвет.
Этапы самостоятельной аудиторной работы:
- Подготовить препараты и окрасить их простым методом и по методу Грама;
- Препараты промикроскопировать с иммерсией;
- Обработать рабочие места и руки;
- Зарисовать результаты микроскопирования в дневник.
Алгоритм приготовления мазка из культуры, выращенной на скошенном агаре («косячке»)
- Предметное стекло аккуратно берут за ребро и с обратной стороны нанесения мазка наносят его границы и номер культуры.
- Зажигают спиртовку, горелку, предварительно выпустив пары спирта.
- Фламбируют поверхность стекла, где будет располагаться мазок.
- Стекло помещают вблизи спиртовки на чашку Петри.
- В левую руку берут пробирку со стерильным физическим раствором (дистиллированной водой) и помещают между 1 и 2 пальцами таким образом, что ладонь находится под пробиркой и горлышко пробирки направлено в зону спиртовки.
- В правую берут бактериальную петлю, как карандаш.
- Петлю фламбируют до покраснения сначала горизонтально, затем вертикально.
- Не выпуская петли, мизинцем правой руки прижимают пробку физ.р-ра к ладони и осторожно вынимают е из пробирки. Движения должны быть плавными.
- Горло пробирки обжигают в пламени и вводят петлю.
- Берут выпускной петлей физ. р-р и выносят на стекло пару капель в границы мазка.
- Закрывают пробку, предварительно проведя через пламя спиртовки пробку и горло пробирки одновременно.
- Ставят пробирку в штатив.
- В левую руку берут пробирку с культурой и помещают, как и пробирку с физ. р-ром (см. пункт №5), петля в правой руке.
- Петлю фламбируют.
- Над пламенем спиртовки спокойно вынимают пробку с культуры (см. пункт №8), одновременно обжигая пробку и горло пробирки.
- Вводят в пробирку петлю, охлаждая ее о стенки пробирки.
- Осторожно закрывают и захватывают петлей культуру, не повреждая агара, и вынимают петлю, не касаясь ею стенок пробирки.
- Петлю с культурой вносят в каплю физ. р-ра и осторожно эмульгируют, незаходя за границы мазка.
- Бактериальную петлю с остатками культуры прожигают до покраснения в пламени спиртовки.
- Прожигают горло пробирки пробку в пламени, одновременно. Закрывают пробирку.
- Пробирку с культурой и петлю ставят в штатив.
- Приготовленный мазок высушивают либо на воздухе, либо высоко над пламенем спиртовки.
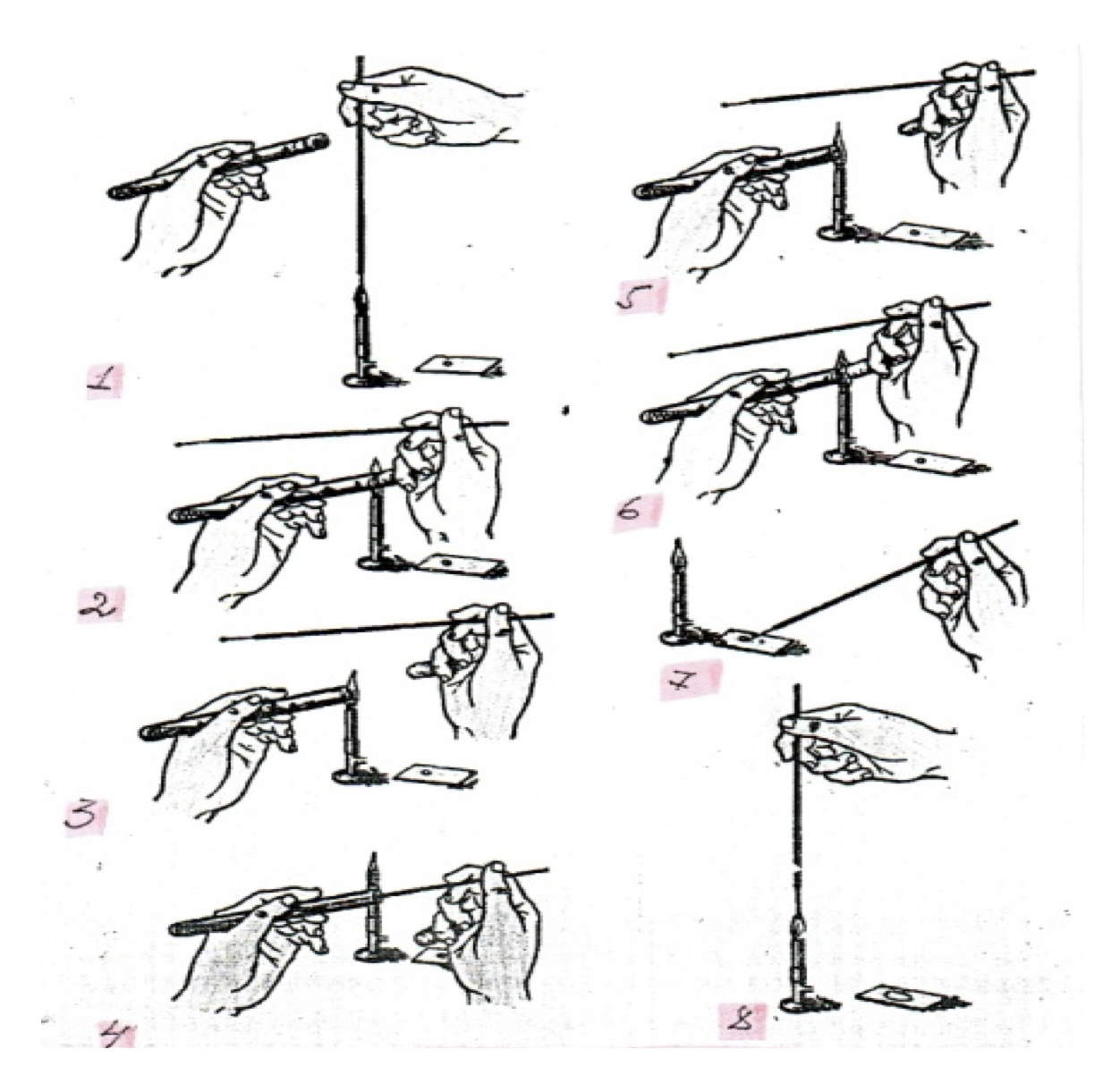
Рисунок 6 – Схема приготовления мазка
Примечание:
- Приготовление мазка из культуры, выращенной на жидкой питательной среде, не требует использования физ. р-ра. Мазок готовят согласно пунктам №13 -№22
- При приготовлении мазка из культуры, выросшей на чашке Петри необходимо:
- отметить изолированную колонию со стороны дна чашки;
- чашку берут в левую руку и в сторону спиртовки приоткрывают крышку, придерживая ее 1и 2 пальцами левой руки;
- прокаленную петлю вводят под крышку чашки, остужая ее о крышку;
- осторожно откалывают часть выделенной колонии и, не задевая края чашки, выносят на стекло с физ. р-ром;
- дальнейшие манипуляции согласно пунктам №18, 19, 21, 22;
- При подсушивании мазка следует помнить: высокая температура может нарушить структуру клетки.
Техника окраски по Граму
- На предметном стекле готовят фиксированный мазок исследуемой чистой культуры;
- Мазок окрашивают красителем генцианвиолетом через полоску фильтровальной бумаги. Можно также использовать заранее приготовленные фильтровальные бумажки, смоченные 1 %-ным спиртовым раствором кристаллвиолета и высушенные (метод Грама в модификации А. В. Синева). В этом случае бумажки помещают на фиксированный мазок и смачивают несколькими каплями воды. Окраску препарата проводят в течение 2–3 мин;
- Фильтровальную бумагу снимают с мазка, краску сливают и наносят на мазок раствор Люголя на 2 мин;
- Раствор Люголя сливают с мазка и обрабатывают 96 %-ным спиртом в течение 30–60 сек. Затем препарат промывают водой и подсушивают фильтровальной бумагой;
- Мазок окрашивают красителем фуксином 2–3 мин, второй раз промывают водой и подсушивают фильтровальной бумагой.
Затем на стекло наносят каплю иммерсионного масла и рассматривают препарат с объективом х90 или х100 при максимальном освещении.
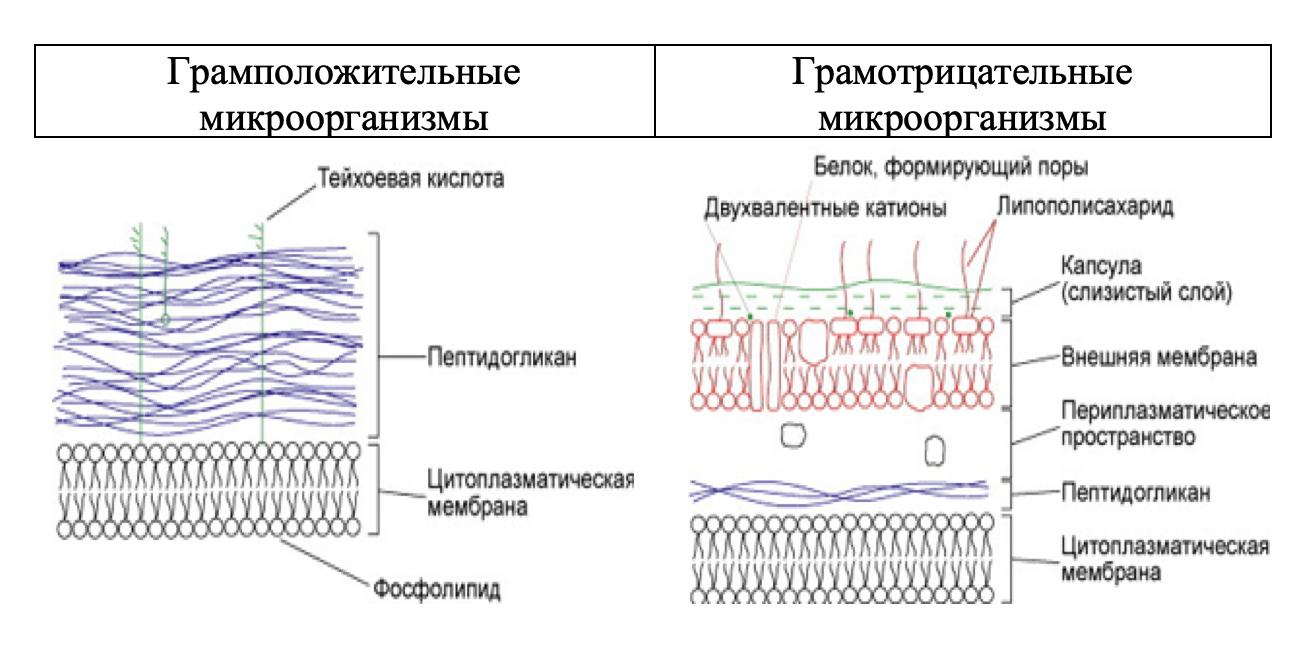
Рисунок 7 – Грамотрицательные и грамположительные бактерии
Генцианвиолет связывается с пептидогликаном клеточной стенки. Толстый слой пептидогликана грамположительных бактерий связывает много красителя, тонкий слой – грамотрицательных – мало. Раствор Люголя фиксирует краситель за счет образования комплекса – краситель-пептидогликан-йод. При обработке мазка спиртом грамотрицательные микроорганизмы быстро теряют краситель и обесцвечиваются, а грамположительные остаются окрашенными в синий цвет. Дополнительный краситель окрашивает грамотрицательные микроорганизмы в красный цвет.
Грамположительные (Гр+) бактерии окрашиваются в сине-фиолетовый цвет. Грамотрицательные (Гр–) бактерии окрашиваются в красный цвет (см. таблицу 4 и рисунок 8).
Таблица 4 – Представители Грам(–) и Грам(+) бактерии
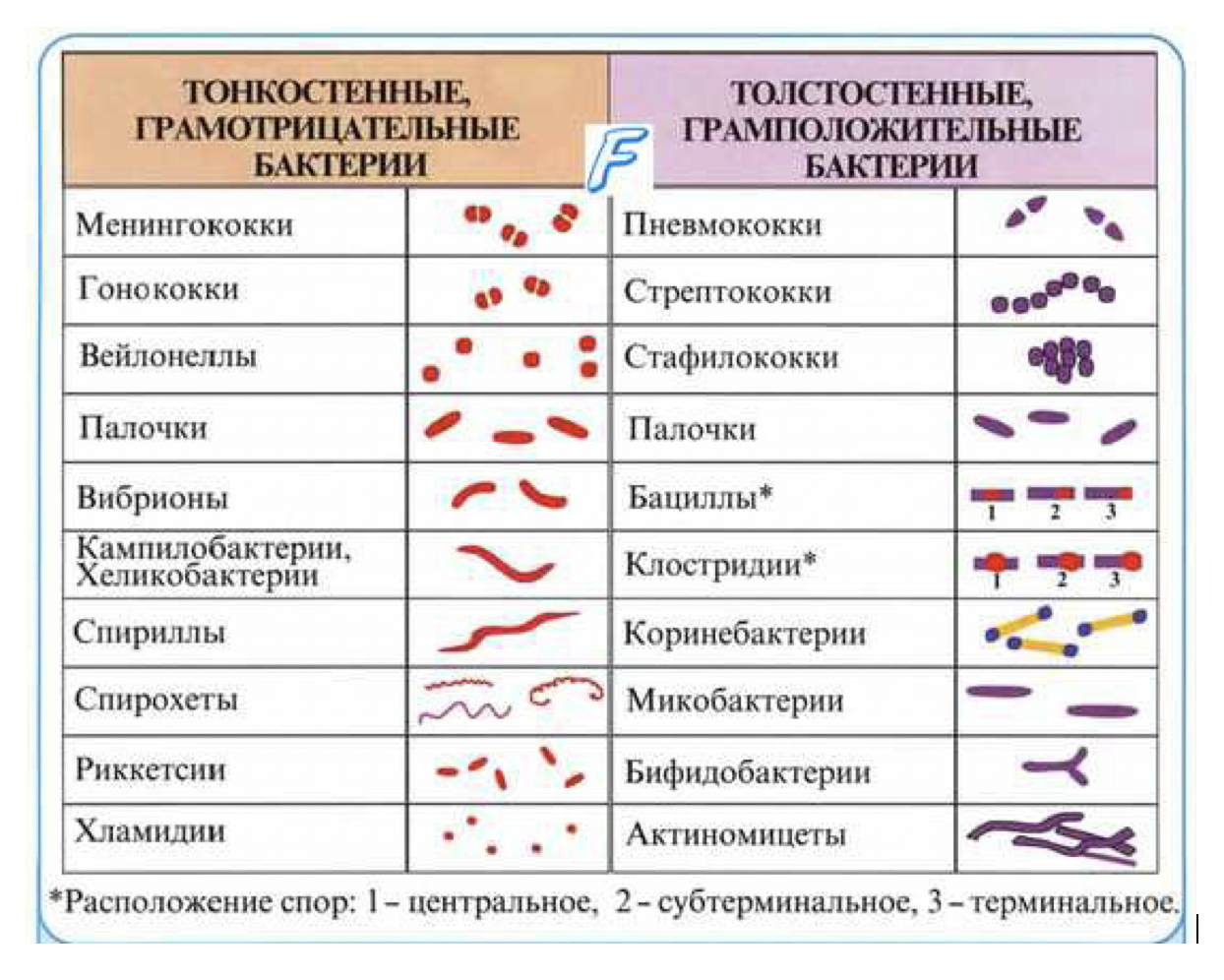
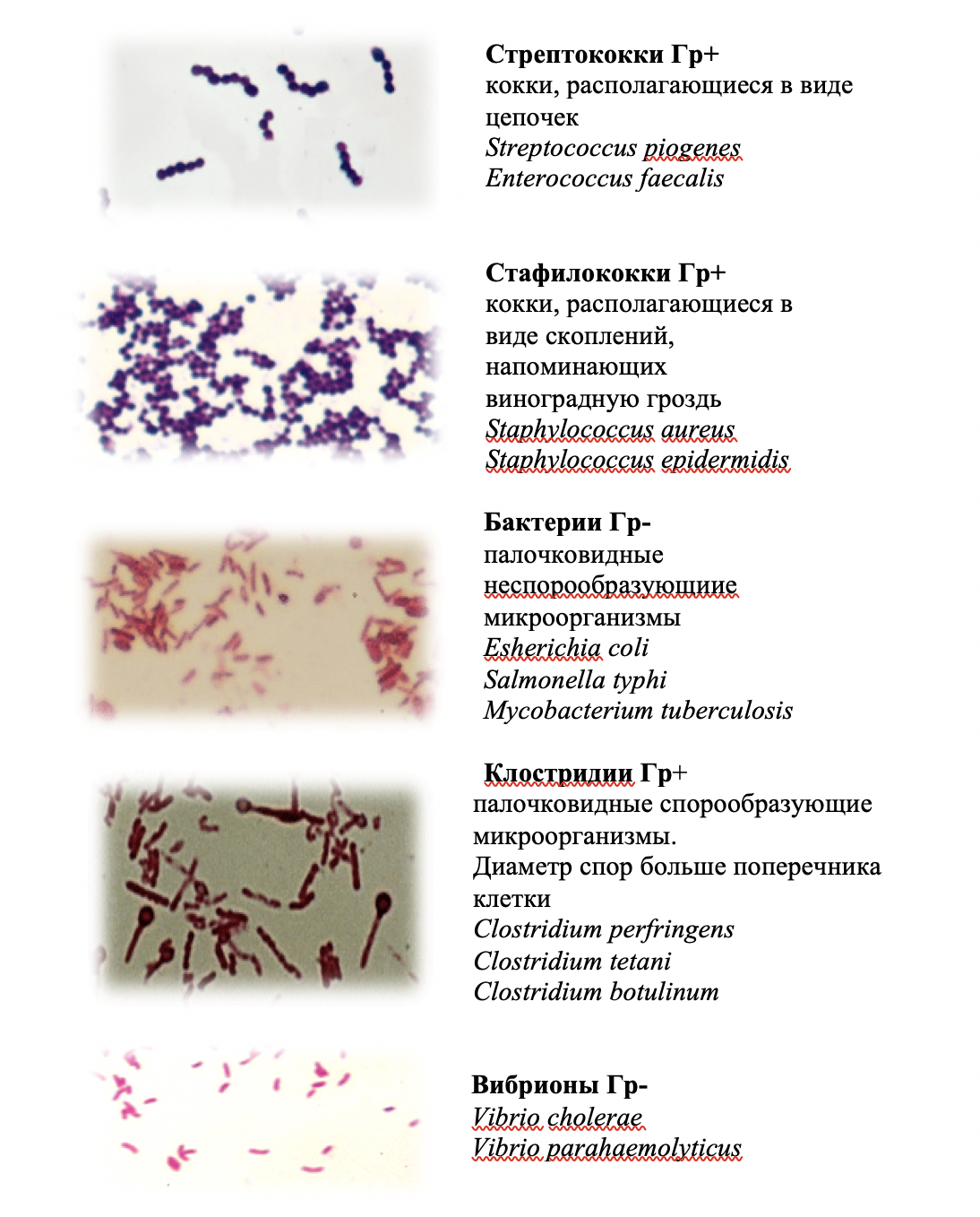
Рисунок 8 – Представители Грам(–) и Грам(+) бактерии при микроскопировании
Окраска спор бактерий по Шефферу-Фултону
Сущность метода заключается в комбинированном действии концентрированного раствора красителя бриллиантового зеленого и температуры на малопроницаемую оболочку спор с дальнейшим обесцвечиванием цитоплазмы вегетативной клетки и ее контрастным докрашиванием сафранином. Таким образом, споры окрашиваются в зеленый цвет, а клетки – в красный.
Техника окраски по Шефферу-Фултону
- На краю предметного стекла (на расстоянии примерно 1,5–2,0 см от края) готовят густой нефиксированный мазок из чистой культуры спорообразующих бактерий;
- На раствор наносят водный раствор бриллиантовой зелени, и мазок с краской нагревают над пламенем горелки до появления пара. Нельзя допускать прикипания краски к мазку. Поэтому препарат периодически отстраняют от пламени. Нагревание мазка с краской проводят в течение 3 мин;
- Краску сливают, препарат быстро промывают водой и просушивают фильтровальной бумагой;
- Окрашивают мазок раствором сафранина 2-3 мин, затем краску сливают, мазок вторично промывают водой и подсушивают фильтровальной бумагой.
Далее на мазок наносят каплю иммерсионного масла и рассматривают под объективом на х90 или х100 при максимальном освещении.
Выявление капсул по методу Бурри, Бурри-Гинса.
Некоторые микробы обладают способностью откладывать на поверхности своего тела мощный слизистый слой вокруг клеточной стенки. Его называют капсулой. В состав капсул входят, главным образом, полисахариды (пневмококк), но у некоторых они содержат и полипептиды (палочка сибирской язвы). Капсулы имеют консистенцию геля, поэтому при микроскопии живых бактерий они видны очень плохо. Для обнаружения применяют негативную окраску. При этом краситель заполняет пространство вокруг бактерий, в результате чего они выглядят светлыми частицами на темном фоне.
Этапы самостоятельной аудиторной работы:
1. Подготовить препарат из культуры и окрасить его по методу Бурри-Гинса;
2. Препараты, подготовленные и демонстрационные, промикроскопировать с иммерсией;
3. Обработать рабочие места и руки;
4. Зарисовать результаты микроскопирования и записать алгоритм метода в дневник.
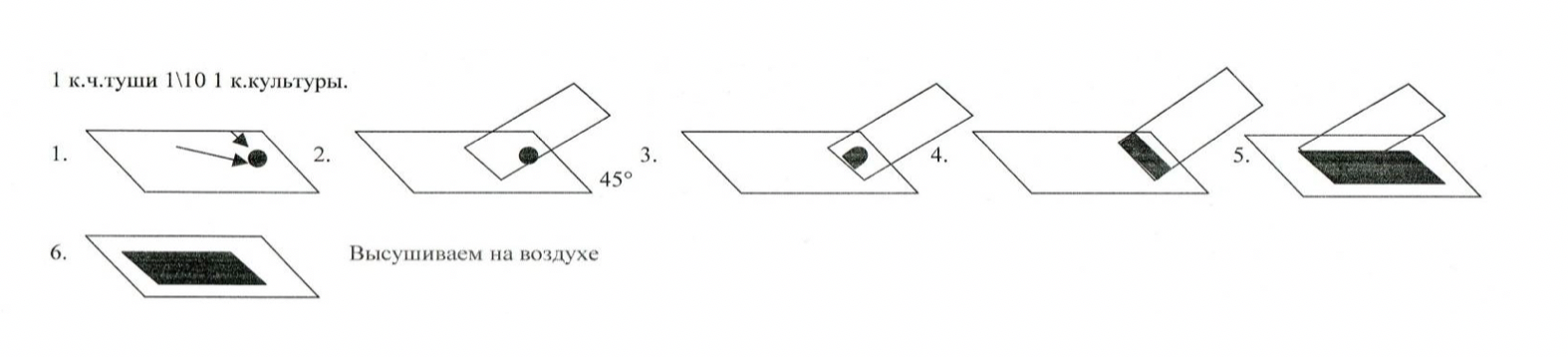
Рисунок 9 – Приготовление мазка для выявления капсулы
Техника окраски капсул по Бури
1. Смешать на предметном стекле немного культуры и каплю туши, разведенной 1:10.
2. Ребром шлифовального стекла сделать тонкий мазок, также как мазок крови: каплю туши наносят на предметное стекло на расстояние одной трети от левого края. В эту каплю бактериологической петлей вносят культуру. Затем краем специально отшлифованного стекла, наклонив его под углом 45 0, прикасаются к капле туши с культурой. Прижимая отшлифованное стекло к предметному, продвигают его вперед. Мазок заканчивается «метелочкой».
3. Сбросить шлифовальное стекло в дезинфицирующее средство.
4. Высушить на воздухе.
5. Бактериоскопировать.
Техника окраски капсул по Бурри-Гинса
1. Приготовить мазок на предметном стекле по методу Бурри
2. Высушить на воздухе
3. Фиксировать химическим способом: погружение стекла в емкость со спиртом или сулемой – 10 мин, или со смесью Никифорова (спирт и эфир 1:1) – 15–20 мин
4. Осторожно промыть водой
5. На мазок нанести фуксин Пфейффера – 3–5 мин
6. Промыть Н2О
7. Высушить на воздухе
8. Микроскопия с иммерсией.
Внимание! Фильтровальной бумагой не пользоваться, чтобы не повредить препарат.
Препарат по Бурри-Гинсу под микроскопом: фон черный, клетки бактерий красные, капсулы неокрашенные (красители не воспринимают).
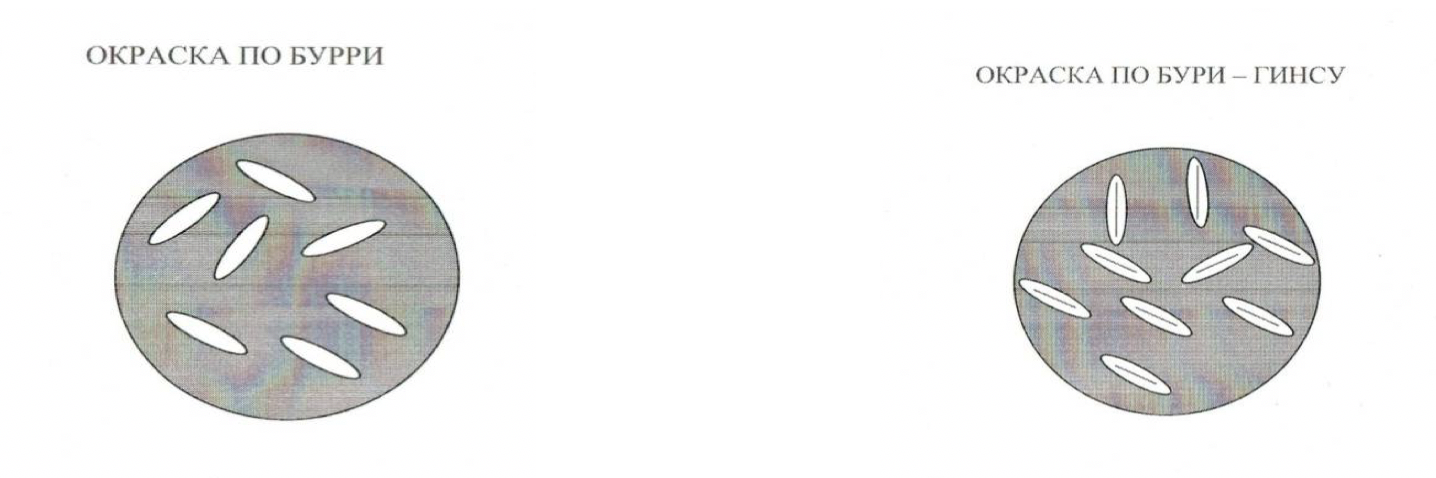
Рисунок 10 – Окраска по Бурри и Бурри-Гинсу
Оформление и анализ результатов исследований
В отчете студенты кратко конспектируют теоретический материал и переписывают сущность и технику окраски бактерий по Граму и спор бактерий по Шефферу-Фултону, капсул по Бурри, Бурри-Гинса. Зарисовывают микроскопические картины исследованных чистых культур бактерий с учетом морфологических особенностей каждого микроорганизма. Под каждым рисунком подписывают латинское название микроорганизма, отношение его к окраске по Граму, увеличение исследованного объекта.