Лабораторная работа № 4 Исследование микроорганизмов в живом (витальном) состоянии. Метод «висячей» капли
Цель работы: изучить способы движения бактерий и их структур, разобраться в сущности этих методов и цели их использования. Освоить технику приготовления.
Оборудование, материалы: микроскоп, бактериологические петли, предметные стекла с лункой, покровные стекла, вазелин или парафин, спиртовка, фильтровальная бумага, 96 %-ный этиловый спирт: лоток с рельсами для предметных стекол, промывалка, чистые культуры бактерий.
Краткие теоретические положения. Определение подвижности микроорганизмов методами нативных препаратов
По способности передвигаться все бактерии делятся на две группы – неподвижные и подвижные. Броуновское движение присуще неподвижным бактериям размером менее 4 мкм.
Бактерии, имеющие один жгутик, называются монотрихами, пучок жгутиков – лофотрихами (политрихами). Биполярные монотрихи или лофотрихи называются амфитрихами.
Скользящий тип движения менее распространен у бактерий. Он присущ миксобактериям, некоторым микоплазмам, цитофагам. Скорость низкая (2–11 мкм/с). Большинство скользящих бактерий выделяет слизь.
Вращательный тип движения присущ извитым формам, например, спирохетам. Они передвигаются за счет колебания собственного тела, очень подвижны.
Таксическое движение Подвижные бактерии могут осуществлять направленные передвижения – таксисы (гр. taxis – расположение), обусловленные различными внешними факторами – стимулами. Таксисы бывают положительные или отрицательные в зависимости от движения бактерий к фактору или от него. Различают несколько видов таксисов.
Хемотаксис – движение, вызываемое химическими веществами. К хемотаксису относится аэротаксис, обусловленный кислородом, и осмотаксис, обусловленный концентрацией солей. По способности индуцировать положительный или отрицательный хемотаксис различают две группы веществ: аттрактанты – вещества, вызывающие скопления клеток в области более высокой концентрации соединения, и репелленты – вызывающие скопления клеток в области наименьшей концентрации вещества.
Вискозитаксис – движение бактерий в направлении увеличения или уменьшения вязкости раствора. Термотаксис – движение бактерий, вызванное источником тепла. Фототаксис– движение бактерий, обусловленное световой энергией.
Магнитотаксис – движение бактерий по силовым линиям магнитного поля Земли или магнита. Магнитотаксис обусловлен наличием у бактерий магнитосом (частички феррина – Fe304, окруженные мембраной), выполняющих роль магнитной стрелки. Ферромагнитные микрокристаллы свойственны магнитотропным бактериям, обитающим в донных осадках морских и пресноводных водоемов.
О наличии жгутиков можно судить по характеру движения бактерий в «раздавленной» и «висячей» каплях при опущенном конденсоре и частично прикрытой диафрагме микроскопа.
Приготовление препаратов для изучения микроорганиз¬мов в живом состоянии
Прежде чем подробно излагать методы приготовления препаратов, необходимо отметить, что от качества приготовления препарата в значительной степени зависит результат микроскопии.
Предметные и покровные стекла, употребляемые для приготовления препаратов, нуждаются в специальной подготовке. Стекла должны быть чистыми и хорошо обезжиренными. Это может быть достигнуто разными способами. Стекла кипятят 15 минут в 1 % растворе соды (или в мыльной воде), споласкивают водой, кладут в слабую соляную кислоту и, наконец, хорошо промывают водой.
Хранят стекла в сосудах (банках) с притертыми пробками в смеси равных количеств спирта и эфира или в 960 спирте или промытыми и вытертыми досуха.
Этапы самостоятельной аудиторной работы:
1. Подготовить препараты висячая капля из культуры, выращенной на жидкой питательной среде
2. Препараты бактериоскопировать в темнопольной микроскопии.
3. Записать результаты микроскопирования и алгоритмы методов в дневник
Метод «висячей» капли
1. Для приготовления препарата необходимы стекло с лункой, покровное стекло, вазелин. Края лунки покрывают тонким слоем вазелина.
2. На покровное стекло наносят каплю культуры, и осторожно накрывают покровное стекло стеклом с лункой так, чтобы капля оказалась в центре.
3. Склеившиеся стекла быстро переворачивают покровным стеклом вверх. Капля находится в герметической камере и сохраняется долгое время.
Если имеют дело с культурой на жидкой среде, то маленькую капельку культуры прямо наносят на тщательно вымытое покровное стекло. Если же имеется культура на плотной среде, то на покровное стекло предварительно наносят маленькую капельку водопроводной воды или физиологического раствора, затем петлей прикасаются к культуре и приставшие к ней бактерии размешивают в приготовленной капельке.
4. Микроскопия сначала при увеличении 8Х. Находят край капли, а затем переводят на большое увеличение 40Х.
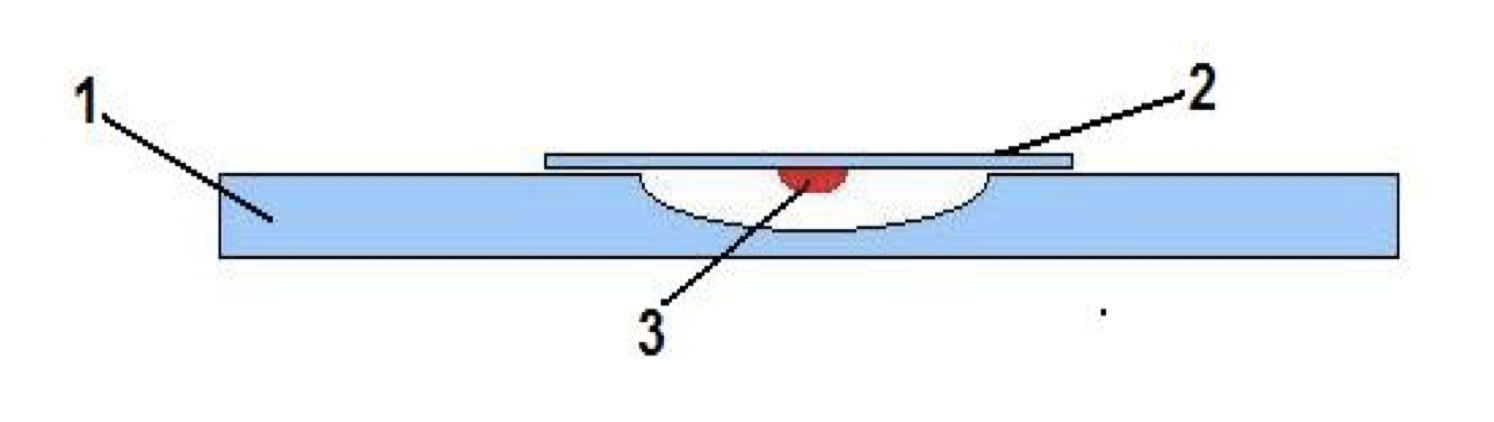
Рисунок 11 – «Висячая» капля. Условные обозначения: 1– предметное стекло с углублением в центре, 2 – покровное стекло, 3 – капля суспензии микроорганизмов
Препарат можно рассматривать как с сухими системами, так и с иммерсионной. Очень хорошо рассматривать живые бактерии с помощью фазово-контрастной или аноптральной установки.
Контрольные вопросы
1. Как провести дифференциацию кокковых форм бактерий по их взаимному расположению?
2. Каким образом можно провести дифференциацию палочковидных бактерий по их внешнему виду?
3. Для чего используются дифференциальные (специальные) методы окраски бактерий? Привести примеры.
4. В чем заключается сущность метода окраски бактерий по Граму?
5. Каким образом проводят окрашивание фиксированных препаратов бактерий по методу Грама?
6. В чем заключается сущность и техника метода окрашивания бактериальных спор по Шефферу-Фултону?
7. Какими методами можно выявить капсулы у бактерий? Как осуществляют окраску капсул по Бурри-Гинсу?
8. Назовите бактерий по расположению жгутиков. Примеры жгутиковых микробов
9. Какие методы определения подвижности микробов?
10. Каковы особенности темнопольной микроскопии?